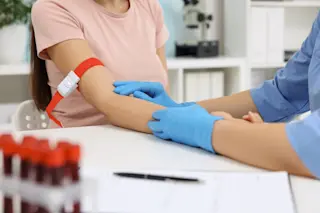
安吉·罗哈斯的细胞即将回到她的身体里。五天前从她的骨髓中提取,经过基因改造并在实验室中培养,这些细胞安然地位于注射器尖端,约有4500万个,在液体中几乎看不见的淡色小点。当医生点头,护士开始“推进”时,细胞通过静脉注射锁流入这名青少年的血液中。那是2001年9月1日,基因治疗正在进行又一次尝试。

患有某种严重联合免疫缺陷病(ADA-SCID)的患者,其关键免疫功能基因存在缺陷。上图概述了一项可能纠正该病的最新基因治疗试验:(1)从骨髓中提取缺陷细胞,(2)将带有健康基因的病毒插入细胞中,以及(3)将改变后的细胞注入患者体内。
何塞·罗哈斯从窗边的座位上站起来,急切地想让女儿的脸保持在视线中。他绕过床尾的监视器伸长脖子。她妈妈露西像往常一样平静地坐着。她和安吉在医院病房的次数多得数不清。这一次,她希望医生能阻止困扰女儿生命的严重免疫疾病。她知道这种治疗是实验性的。安吉邀请来的年轻表妹丹尼斯紧紧依偎在露西身边,女孩睁大眼睛四处张望,不确定该如何反应。
洛杉矶儿童医院窗外的空气明亮而炎热。棕榈树点缀着陡峭的山坡。从亲戚们坐的地方,著名的“好莱坞”标志清晰可见,栩栩如生。尽管房间里除了家人还有许多见证这场正在展开的医疗剧的人,但却没有喧闹声、闲聊声,也没有灯光或摄像机。一种期待感夹杂着平淡无奇,仿佛这是一部开头就不怎么精彩的电影的重播。
十年光阴,天壤之别。1990年9月,美国国立卫生研究院在马里兰州贝塞斯达进行了首次人体基因治疗试验。那次实验中的年轻患者阿桑蒂·德席尔瓦,简称阿什,与安吉丽卡·罗哈斯患有同样的疾病。他们罕见的基因疾病被称为ADA-SCID——由白细胞无法产生关键酶腺苷脱氨酶(ADA)导致的严重联合免疫缺陷(SCID)。
当时和现在一样,实验的最终目标是将健康形式的ADA基因植入患者细胞中,以恢复其免疫功能。官方而言,试验的目的是为了观察基因转移是否安全。食品药品监督管理局批准了这两项程序作为第一阶段实验。在这种初步试验中,实际的治疗益处被视为额外的收获。
其他巧合:阿什和安吉都是移民的女儿,年龄相仿——安吉在12月刚满16岁,比她大九个月。负责这项试验的医生兼科学家唐纳德·科恩,曾与国家卫生研究院(NIH)进行阿什试验的团队一起接受过培训。然而,1990年基因治疗的宣传力度很大——NIH研究人员在阿什试验前举行了一场大型新闻发布会,记者们仍然试图偷偷溜进医院看她——科恩对关注持谨慎态度。“在某些方面,这对我和儿童医院有好处,”他说,“但宣传对2001年的基因治疗研究人员来说可能不是个好主意。”
科恩指的是1999年在费城进行的一项完全不同的基因治疗实验中,患者杰西·盖尔辛格的死亡。盖尔辛格对一种携带治疗基因进入肝脏的工程病毒产生了极度反应。这一事件促使FDA收紧了该领域研究人员的规定,并引发了对安全性的普遍担忧。去年夏天,美国基因治疗学会前会长宣称:“基因治疗学科的公众信心受到了严重损害。”会长还注意到,费城首席研究员涉嫌存在经济利益冲突,如果试验成功,他的生物技术公司将从中获利,以及随后其他医疗机构“严重漏报患者不良事件”的披露。“不良事件”包括六起患者死于其基础疾病的案例,显然与基因治疗无关。更常见的是,受试者出现的发烧和其他令人担忧的并发症从未引起政府的注意。
即使在盖尔辛格去世之前,直接基因治疗的结果也令人费解地糟糕。自阿什的开创性实验以来,美国已经启动了450多项基因治疗试验。尽管这些试验招募了4000名受试者,但没有一项试验表明可以通过改变一个人的基因来治愈或控制疾病。
尽管如此,基因治疗的理念仍然引人注目——从DNA层面解决疾病的根源。但技术问题有两个:首先,如何将足够的基因转移到患者体内。通常利用病毒来完成这项任务,因为病毒能够将它们的基因插入细胞并迫使它们制造外来蛋白质。除了少数例外,用于基因治疗的病毒都被改造得无法复制。它们唯一的功能是潜入细胞并传递一个DNA包裹,即所需的“人类基因”。
基因治疗的第二个挑战是让基因一旦插入,就能产生足够所需的蛋白质。天然病毒携带着调节其基因的分子开关,但工程病毒需要帮助。一个叫做启动子的DNA序列被插入病毒中;它开启基因,产生一种被认为可以纠正疾病的蛋白质。在ADA-SCID中,所需的蛋白质就是ADA酶。
1990年,当阿什(Ashi)获得ADA基因时,科学家们还不了解他们面临的障碍,也未曾预料到接踵而来的失望。最初的实验似乎奏效了,至少是部分奏效,结果备受赞扬。阿什基因治疗的“成功”激励了全国各地的研究人员启动他们自己的人体试验。确实,女孩体内循环的T细胞(一种白细胞)中约有四分之一产生了ADA酶,这表明基因是活跃的。但额外添加的基因未能产生足够的酶来保护她免受感染。因此,阿什,就像1990年代的安吉·罗哈斯一样,一直需要非常昂贵的药物。随着细胞今天流入安吉的胳膊,关于她的前辈以及基因治疗总体情况的结论仍未确定。
一直坐在床边的唐·科恩突然想到什么,走到露西和何塞跟前。他向这对父母传达了基因治疗可能带来的最有希望的消息。自2000年春天以来,法国研究人员报告称,他们在治疗X-SCID方面取得了越来越大的成功。X-SCID是一种与ADA-SCID相似的免疫缺陷病,但由于尚无药物治疗,因此更具威胁性。最初有两名儿童,后来增至五名;现在已有七名,其中包括一名青少年,他们的免疫系统通过基因转移得以恢复,并且仍在强劲运行。这会是永久性的治愈吗?现在下结论还为时过早。最棒的是,法国团队采用的一些实验室技术正是由科恩本人开发的。
一开始,医学遗传学专注于儿童和酶缺陷。1902年,第一种与单一遗传特征相关的疾病是苯丙酮尿症。英国人阿奇博尔德·加罗德爵士研究了一些家庭,其中一些孩子会产生红色或黑色的尿液以及相同奇怪颜色的耳垢。他们还有关节炎的症状。他们的兄弟姐妹都没有这些特征。

唐纳德·科恩依靠拨款支持他在洛杉矶儿童医院的基因治疗试验。“我很穷,但很诚实——也许还有点傻,”他说。摄影:吉莲·劳布
尽管他不知道基因是什么,但加罗德怀疑患有这种疾病的孩子遗传了双份的“因子”——每个父母各一份。加罗德认为该因子会产生一种酶,如果两个因子都有缺陷,那么酶的缺乏就会导致疾病。将孟德尔定律应用于他的发现,加罗德描绘了这种“先天性代谢错误”的家族谱系。
苯丙酮尿症现被列为隐性基因疾病,自1902年以来已有数百种被归类。正如加罗德推测的那样,基因成对遗传,而患有隐性疾病的人不幸地从父母双方都获得了有缺陷的基因副本。拥有单个有缺陷的基因副本通常不是问题,因为这些疾病通常涉及酶,而该人正常的基因副本通常可以产生足够多的特定酶,以使代谢途径保持良好秩序。然而,如果酶含量过少或缺失,不良影响会在出生后不久显现出来,此时孩子必须依靠自己的代谢系统,而不是母亲的。根据约翰霍普金斯大学研究人员最近的一项文献调查,“在生命第一年发病的疾病中,编码酶的基因缺陷导致的比例异常高。”
导致ADA-SCID的代谢紊乱在1970年代得到澄清。ADA酶能清除T细胞中的某些代谢废物。如果T细胞因ADA缺乏而无法做到这一点,它们就会死亡。当T细胞死亡时,免疫系统就会衰竭,SCID疾病就会爆发。
在20世纪80年代,这种疾病的核心基因被鉴定出来。此外,ADA基因被克隆,以便用于实验。研究人员将ADA基因插入一种工程小鼠病毒中,然后诱导该病毒感染细胞培养物,从而弥补了基因缺陷。这一切为安吉·罗哈斯和唐·科恩的相遇奠定了基础。
科恩的医学职业生涯始于儿科免疫学家。20世纪80年代末,他离开美国国立卫生研究院前往洛杉矶时,露西·罗哈斯正努力让她的婴儿女儿活下来。露西在她两个大孩子身上经历的常见疾病,在安吉患病时要严重得多——哮喘发作,发烧飙升至105度,耳部感染严重到需要手术。母亲被告知,“如果你不24小时看护这个孩子,她就会去世。”
未被诊断的SCID儿童通常在2岁前死亡。如果诊断得当,他们会将自己的日子封闭在塑料隔间里,就像1984年最终因X-SCID去世的令人心碎的“泡泡男孩”大卫一样。尽管安吉的免疫系统漏洞百出,但她似乎产生了足够多的ADA酶来抵抗常见的细菌和病毒。正如一位医生评论的那样,“她很幸运没有遇到一个坏细菌。”
1991年,当洛杉矶儿童医院的专家们首次见到她时,安吉患有肺炎。当时考虑进行骨髓移植,使用她哥哥的细胞。科恩和移植科的其他医生曾将这种手术作为白血病和其他严重血液疾病儿童的最后手段。然而,SCID患者在骨髓移植后的存活率仅为三分之二,而且这些患者当时并没有肺炎。
幸运的是,安吉还有另一种选择:药物治疗。她的疾病被诊断出来时,一种源自牛的ADA药物刚刚问世。这种名为PEG-ADA的药物每周注射两次。她的母亲被告知如何在家里给安吉注射。这种治疗每年花费数十万美元。在过去的十年里,罗哈斯夫妇在定期带安吉去医院复查的同时,设法让他们的医疗保险公司和州政府承担了这笔惊人的费用。然而,在安吉停止需要这种药物之前,这种援助将会中断。不出所料,SCID家庭和医生都渴望找到一种替代高风险移植和高成本药物的方案。
11年前,在阿什·德席尔瓦的试验中,T细胞从她的血液中过滤出来,暴露于带有基因的病毒,然后重新注入她的身体。研究人员知道,更好的目标是干细胞。它们寄居在骨髓中,与胚胎干细胞不同,但具有同样的柔韧性。它们不仅能产生T细胞和免疫系统的其他组成部分,还能编程细胞识别多种不同的传染源。缺乏ADA基因的干细胞不会受损,但它们产生的每个T细胞都存在致命缺陷。设想一下,如果修复了干细胞,所有后续的T细胞都应该茁壮成长。
现在是六月,离手术还有三个月。患者和家属正在听取简报。“我们会尝试将基因植入骨髓,”科恩对露西和何塞说,“然后我们会通过手部静脉将安吉的细胞还给她。”他转向安吉。“这就像给自己做骨髓移植,但希望骨髓已经修复,并且可以制造出你所需的所有不同细胞来对抗一切。”
诊察室里挤满了人。除了科恩和罗哈斯一家,还有两名研究团队成员、一名医院公共事务代表、一名翻译和一名社工。翻译将科恩的话翻译成西班牙语,以确保露西和何塞理解他的意思,而社工则在做笔记,监督会议的伦理方面。
这是一次知情同意会议,讨论风险和益处,之后父母必须决定是否让安吉参加临床试验。安吉穿着黑色运动鞋、黑色裤子和蓝色运动衫,盘腿坐在检查台上。她的家人和医院团队成员围成半圆形坐在椅子上。习惯了成为医疗关注的中心,女孩很快就面带微笑,直言不讳。她身材结实,肩膀宽阔,在高中乐队中演奏萨克斯。
科恩告诉家人,“这是一项研究,而不是治疗。如果安吉不想参加这项研究,也没关系。她会得到同样的照顾。我们希望你们感到可以在没有任何压力的情况下做出这个决定。”
安吉和她的妈妈此前已经和科恩见过面,都赞成继续进行。现在何塞必须满意。他拒绝坐下,问道:“那这是一项实验吗?”
科恩说是。他一边嚼着口香糖,一边放慢语速以便翻译,然后宣读了研究方案。他首先描述了ADA-SCID,“安吉遗传的一种基因疾病。安吉体内的一个基因不起作用……”
角落里一只手举起来。“我有个问题,”安吉笑着说,仿佛又回到了学校。“我怎么会得到这个基因?你知道是来自哪位父母吗?”
医生请她稍后再提问。他有条不紊地总结了她疾病的药物和移植治疗。然后他谈到了基因治疗的先例。阿什是SCID领域的先驱,但科恩本人在1993年进行了一项试验,当时对这项新技术的兴奋达到了顶峰。三名患有ADA-SCID的婴儿被输注了缺失的基因。由于患者太小无法提供骨髓,科恩转而使用了胎盘脐带血中的干细胞。当这些经过改造的干细胞被重新注入儿童体内时,一小部分干细胞产生了含有ADA基因的T细胞,但基因未能产生蛋白质。由于仍然缺乏ADA,患者不得不继续服药。
“带有基因的T细胞增加了,”科恩说,“但T细胞的基因没有‘开启’。我们击出的是二垒安打,而不是全垒打。”因此,在1990年代中期,科恩重新开始研究,以提高基因转移的效率。并且还需要在干细胞的实验室培养方面做更多的工作。因此,科恩和他的研究团队开发了一种更强大的病毒载体,并改进了生长因子——这些补充剂在病毒将基因导入干细胞时滋养它们。法国科学家在他们有望成功的X-SCID治疗中使用了这些新的生长因子。
“这种新方法会比我们以前做得更好吗?”科恩说。“这就是我们正在努力寻找的答案。”
在与家人讨论手术风险时,他提到了杰西·盖尔辛格的死亡。他没有匆匆带过,但也没有过多纠缠。“那是一种不同的病毒,他们试图直接将其注入他的体内。他反应强烈,不幸去世。这是意想不到的。但(费城试验中所有受试者中)只有他遇到了这个问题。”
何塞和安吉不安地骚动起来,但露西却连眼睛都没眨一下。
科恩重复道:“这是出乎意料的。不过,它告诉我们,坏事是可能发生的。”他指出,安吉在提取骨髓时必须接受麻醉,从统计学上讲,这更具风险。他走到检查台前,第一次触碰安吉的臀部。“我们从骨盆后上方提取骨髓。”女孩的运动鞋在白色薄纸上发出沙沙声。“我们两边都取。”
何塞问:“她以后有可能不需要打针了吗?”
“有可能。如果基因有效,我们会尝试让她停药。”
安吉又举起了手。“问题。我一直想知道:家里谁患过这种病?”
科恩解释了隐性遗传病的性质。“可能你的父母各带有一个缺陷基因。你会把那个有缺陷的ADA基因传给你的孩子,但如果父亲的基因是好的,你的孩子就不会有问题。”
“我这种病有多罕见?”
“我们不知道。百万分之一?每年有十个孩子前来就诊。”
“哇,我真幸运。”
医生笑了。“是的,这非常罕见。你很特别。”
“我会是(这次试验中的)第一个吗?”
科恩表示同意。知情同意书已签署。
SCID疾病之所以成为基因治疗实验的良好目标,原因有几个。第一,只需要纠正一个基因。第二,只有一种细胞需要这个基因,即骨髓干细胞。第三,干细胞的操作可以在体外进行,与体内技术相比,提供了更大的控制。在体内技术中,载体或多或少地被喷射到器官或肿瘤上,无法保证病毒能够避开身体的防御并将其遗传物质输送到正确的细胞中。

左边的安吉·罗哈斯和她18岁的姐姐苏西坐在洛杉矶的卧室里。安吉说,她的病情影响了她的两个健康的兄弟姐妹,“因为我妈妈总是在医院照顾我。”摄影:吉莲·劳布
最后,研究人员了解到,插入基因的调控不必非常精确。为了对抗ADA-SCID或X-SCID,基因可以产生大量蛋白质或少量蛋白质。无论哪种方式,都会产生益处。其他疾病则需要更精确的基因活性调控。
在临床试验的鼎盛时期,即20世纪90年代初期,基因治疗师除了SCID之外,还治疗了许多单一基因疾病。其中最突出的是囊性纤维化,一种肺部疾病,会使一半的患者在30岁前死亡。囊性纤维化基因——或者更确切地说,其缺陷导致疾病的基因——于1989年被发现,这燃起了研究人员修复患者受损气道的希望。经过大量的宣传和多次尝试,这些试验被认为是失败的。患者肺部的黏液阻碍了载体穿透呼吸道细胞,而设法进入的基因则被免疫反应中和了。即使新基因成功扎根,治疗也不会持久,因为气道内壁的细胞不断更新。理想的目标将是肺组织的亲本或前体细胞,但这些细胞的身份尚不清楚。
囊性纤维化的故事具有代表性。然而,尽管单一基因疾病难以治疗,研究人员却转向了更复杂的疾病。根据南加州大学的布雷特·鲍尔和W·弗伦奇·安德森在2000年末的一篇综述,自1990年以来,绝大多数基因治疗工作都集中在癌症上,尽管癌症在基因组中没有单一靶点。艾滋病位居第二,有33项试验已启动或提议。经典的单一基因疾病仅占50项试验,其中20项用于囊性纤维化。
因此,最有可能通过这项新技术治愈的疾病受到的关注最少。原因不难理解。鲍尔和安德森写道,对于SCID等罕见的遗传性疾病,“对昂贵的研究和临床试验的投资回报潜力很小”。翻译过来就是:制药公司没有投资的动机。相比之下,“更常见的疾病”,如癌症、心脏病和艾滋病,“对制药公司来说是诱人的目标”。此外,实验人员拥有充足的患病人群,对他们来说,参加基因研究的风险似乎非常值得。
美国国立卫生研究院在1995年发布了一份报告,批评研究人员忽视了基础科学,特别是动物模型,这些模型本可以解决程序中的问题。唐·科恩回忆起那个时期:“当时进行临床基因治疗的热情非常高。在医疗中心,进行试验,特别是针对黑色素瘤等绝症的癌症试验,比进行小鼠研究能获得更高的社会回报。当时的思路是,你不知道它是否会奏效,但考虑到这种疾病,你认为它不会造成伤害。”
直到杰西·盖尔辛格的去世,才震撼了这个领域并收紧了标准。现在,在法国团队在X-SCID方面取得突破之后,人们的注意力再次集中在由酶缺陷引起的基础疾病上。安德森是阿什·德席尔瓦试验的共同负责人,他一如既往地坚定地表示:“如果你无法治疗SCID,你就无法治疗任何其他疾病。”
安吉·罗哈斯仰卧在病床上,努力保持清醒。当干细胞被缓慢推入她的手臂时,她正因输注苯海拉明(一种在测试前为防止注射部位发炎而给予的抗组胺药)而昏昏欲睡。科恩不担心出现急性、危及生命的反应。他相信15年来对动物和人类SCID受试者的经验,虽然不能保证成功,但已将对安吉的危险降至最低。
私下里,科恩认为,在接下来的几个月里,健康的T细胞出现的可能性只有四分之一,它们可能会挽救她的免疫系统。他之所以不确定,是因为他不知道有多少干细胞被载体改变了,也不知道它们是否会在她的骨髓中扎根。
正在进行注射的护士黛布拉·图姆巴雷洛俯身在病人身上。“你感觉怎么样,安吉?”
她迷迷糊糊地说:“很好。我没死。”她的心率已经升到每分钟94次,可能是焦虑造成的。
五分钟后,一切结束,房间开始清空。科恩回忆说,他在1993年SCID试验中的一位同事曾敦促将注射器保存起来,供史密森尼学会收藏,因为那是一件国宝。这个注射器不会。
露西如释重负地说:“我以为会有个大容器(装细胞)。这么小真好。”她脖子上戴着一个十字架。
医生与何塞握手道别,说:“我们还得等两年才能确定。”
“来这里十年了,”安吉的父亲沉思道。“多少次了?”他问妻子。
“如果安吉要发生反应,”图姆巴雷洛说,“她早就发生了。”
女孩的心率已降至80。她平静地睡着了,新的基因在她的血液中流淌。

如需一般信息,包括一篇关于基因治疗基本科学的精彩入门文章,请访问宾夕法尼亚大学人类基因治疗研究所网页:www.uphs.upenn.edu/ihgt。
如需了解更多关于南加州大学基因治疗研究的信息,请访问cwis.usc.edu/schools/medicine/academic_departments/biochem_molbiol/igm.html。
如需了解政治问题更新和进行中的临床试验链接,请访问美国基因治疗学会网站:www.asgt.org。
如需了解更多关于SCID的信息,包括各种形式和治疗方法,请访问www.scid.net/scidpid.html。