在一个寒冷的星期二早上,三月的一天,克里斯蒂安·吕舍尔(Christian Lüscher)在他的实验室大楼下方蜿蜒曲折的巨大地下隧道里跳上自行车,骑行到附近的日内瓦大学医院。
当他抵达手术室时,一个手术团队已经为一名病人剃光了头发,用金属框架固定住她的头部,并在她的头骨两侧钻了两个硬币大小的孔。她68岁,是一名退休的联合国雇员。
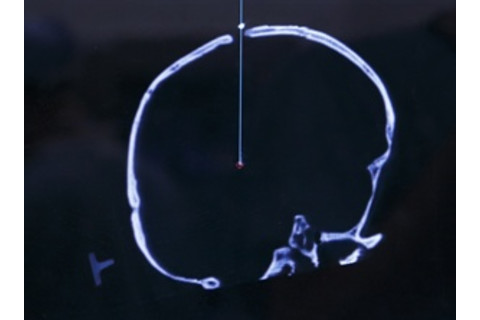
深部脑刺激涉及插入一个头发丝粗细的临时电极,以找到永久性电极的最佳位置和振幅。这张扫描图显示电极穿过颅骨下降到一个将刺激异常神经元的位置。研究人员发现,重塑大脑连接可以逆转成瘾。Bob Croslin
吕舍尔立刻注意到了她的震颤。从她的手指到脚趾,病人的整个右侧每秒颤抖四五次,因为她大脑深处的神经元自发地放电,将电脉冲发送到她的运动皮层和脊椎,导致她的肌肉不自主地收缩。
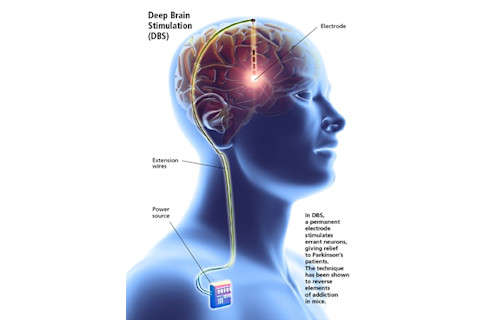
吕舍尔是一位多年来一直治疗帕金森病的神经学家,对她的病情非常熟悉。然而,当这位现年52岁的科学家看着一位神经外科医生和他的团队准备使用一种名为深部脑刺激(DBS)的技术时,另一种截然不同的病人从未离开过他的脑海。
近15年来,吕舍尔一直致力于解开毒品成瘾的奥秘。现在,他相信自己已经非常接近实现几年前大多数人认为不可能的事情。通过掌握DBS,吕舍尔旨在重新连接吸毒者的大脑,并实际上逆转他们的成瘾。
吕舍尔站在手术室附近,一位神经外科医生看着显示病人大脑图像的监视器。然后他慢慢地将一根细得出奇的、带电极尖端的杆子插入她的大脑皮层,穿过胼胝体,再深入。一系列“噼啪”作响的爆炸声开始充斥房间。这些是脑细胞放大的放电声音,由电极拾取并通过附近的扬声器播放。吕舍尔和一位神经科医生同事一起密切观察帕金森病患者,并倾听。当“噼啪”声开始与她的肌肉抽搐同步时,他们向外科医生发出了信号。他们已经接近导致无法控制的震颤的神经中心。
Pasieka/科学图片库/Corbis
神经学家在电极末端开启了一系列快速的电流脉冲,调整其位置和振幅,直到目标区域的所有神经元都开始放电。抽搐减慢了。然后停止了。他拔出临时电极,插入永久电极。病人的磨难几乎结束了。她将在三天后回来,医生将在她的胸部,锁骨下方插入一个电池供电的设备。然后他们将延长线从她颈部皮肤下方连接到她大脑中的电极,并打开它。只要设备刺激被疾病损害的异常神经元,震颤和瘫痪就会停止。
吕舍尔向手术团队告别,骑车回到他的实验室,脑海中浮现的一个诱人景象令他振奋。如果治疗成瘾可以如此简单呢?这对数百万吸毒者和他们的亲人意味着什么?这对社会又意味着什么?
这个愿景可能比我们想象的更接近现实。今年2月,吕舍尔在《科学》杂志上报道称,他成功修改了用于帕金森病患者的技术,以治疗小鼠的可卡因成瘾。吕舍尔给小鼠注射了一种暂时阻断大脑中关键蛋白质的药物。然后他给一个神经区域施加电刺激,这个区域在人类大脑中距离帕金森病患者靶向的杏仁状区域仅几厘米,科学家们已将这个大脑区域与成瘾联系起来。吕舍尔的结果是明确的。这项技术重塑了小鼠的大脑,似乎逆转了成瘾的关键要素。
“这是一种非常务实的方法,我们希望未来能将这项技术应用于人类,”吕舍尔说。

神经学家克里斯蒂安·吕舍尔已经工作了15年,试图破解成瘾大脑中发生的事情。克里斯蒂安·吕舍尔
一场艰苦的战斗
多年来,人们一直告诉吕舍尔,他的努力听起来异想天开,甚至不可能。在20世纪90年代,当他刚获得博士学位进入这个领域时,许多医生和科学家拒绝承认成瘾是一种疾病。
在他的关于毒品成瘾生化基础的讲座结束后,听众中会有医生、社会工作者、精神病学家站起来,其中许多人每天都在与可卡因、海洛因和羟考酮的肆虐作斗争的前线。他们会悲伤地摇头,仿佛即将向诊所的一个家庭宣布一个残酷的事实。
“我们不要将成瘾医学化,”他们会告诉他。“你正在研究一些不真实的东西。这是心理上的。没有器质性关联。”
几代以来,证明成瘾是一种真实的身体脑部疾病的医学证据一直困扰着科学家们。阿尔茨海默病导致大量脑细胞死亡,并使器官外围区域萎缩。癌性肿瘤在大脑果冻状的褶皱中显得突出,就像月球上的陨石坑。在已故瘾君子的大脑中,没有发现此类线索——尽管他们的生活中常常留下大量可见的残骸。“确定某人是否患病金标准是进行尸检,”吕舍尔说。“但使用病理学家拥有的标准工具,成瘾者的大脑中并没有太多问题。”
吕舍尔比大多数人更清楚地知道,认为吸毒和酗酒在很大程度上是精神问题,从而只是意志力问题,是一种谬论。作为1996年的一名博士后,吕舍尔前往加州大学旧金山分校,参与了一项有助于解开与学习和记忆相关的神秘生化变化的实验。
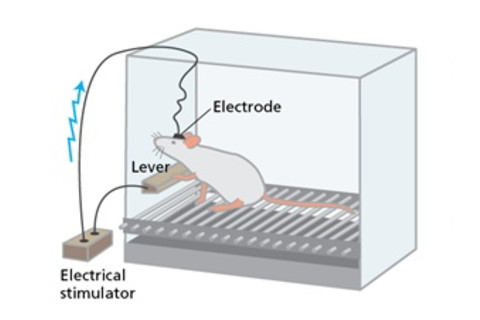
老鼠会每小时按动杠杆数百次,以刺激大脑的“快乐中枢”。Alison Mackey/Discover
吕舍尔和他的同事们证明,某些形式的联想学习反映在一种名为AMPA受体的微观蛋白质的出现上。这些受体在两个神经元相遇的微小缝隙(称为突触)处大量生长,并以更强的键将神经元“连接”起来。吕舍尔坚信,这些相同的过程总有一天会解释成瘾。
所以,在那些早期的讲座中,吕舍尔会站在那些怀疑者面前,礼貌地听取他们的批评,然后解释他们为什么错了。成瘾并没有杀死神经元;它以一种破坏性和适应不良的方式重塑了它们之间的连接。而且很快,科学家们就会找到一种方法来证明这一点。
那一天终于在2001年到来,当时一个加州大学旧金山分校(UCSF)团队通过分离出小鼠接触可卡因后大脑中出现的独特、持久的生化变化,震惊了成瘾研究领域。这种“成瘾痕迹”证明成瘾是一种医学状况;多年来,关于其神秘机制的证据一直在缓慢积累。大脑的甜蜜点
引发现代成瘾研究时代的发现完全是偶然发生的。在20世纪50年代早期,麦吉尔大学的一个实验室里,博士后詹姆斯·奥尔兹正弯腰对着一只老鼠,试图将电极连接到他怀疑与疼痛相关的大脑区域。
奥尔兹和研究生彼得·米尔纳计划每次老鼠走到笼子里的特定角落时,就电击它。但是,老鼠非但没有在电极激活时退缩,反而似乎很享受这种体验。它没有躲避角落,而是急忙跑回那里。当两人进一步调查时,发现原来在设置过程中,电极松动了,卡在了大脑附近另一个区域。
奥尔兹和米尔纳修改了实验,让老鼠通过按压杠杆来自行施加脉冲。当他们将电极放在一个特定的“甜点”时,有些老鼠每小时按压杠杆数百次。在奥尔兹随后的实验中,有些老鼠每小时按压杠杆多达数千次。它们忽视食物和水。有些甚至自我刺激到精疲力竭而倒下。
奥尔兹假设该区域由相互连接的脑细胞回路组成,这些回路可以被基本欲望的满足所激发,这些大脑回路可能包含享乐主义的本质。一家报纸给该区域起了著名的名字:“快乐中枢”。
将这些强迫性自我刺激老鼠的行为与人类酗酒者或吸毒者狂欢的行为联系起来,并不算牵强。
在20世纪70年代,研究人员开始关注大脑中一种特定的神经化学物质。科学家们已经知道大脑的主要信号传导剂是神经递质,这是一种在神经元被激活时释放的化学信使。这些信使穿过连接兴奋神经元及其邻居的突触,并与邻近细胞表面的蛋白质结合。这反过来会影响有多少带正电的离子被允许进入这些邻近细胞的内部,以及它们自身放电的可能性。当它们放电时,它们会向邻居释放神经递质,从而导致它们被激活,依此类推。
Alison Mackey/Discover
研究人员认为这些神经递质与寻求药物的老鼠的强迫行为有关。罗伊·怀斯想找出是哪一种。奥尔兹直接用电极刺激老鼠的大脑,而怀斯,当时蒙特利尔康考迪亚大学的研究员,则通过静脉输液管间接刺激,输送安非他明等药物。当他给老鼠喂食阻断神经递质多巴胺的药物匹莫齐特时,他获得了成功。在低剂量下,老鼠试图更快地按压杠杆以增加安非他明的剂量。当怀斯给它们喂食大剂量匹莫齐特时,它们失去了兴趣。这意味着似乎很清楚:多巴胺是安非他明刺激快乐中枢所必需的,它的存在以某种方式帮助刺激了强迫行为。
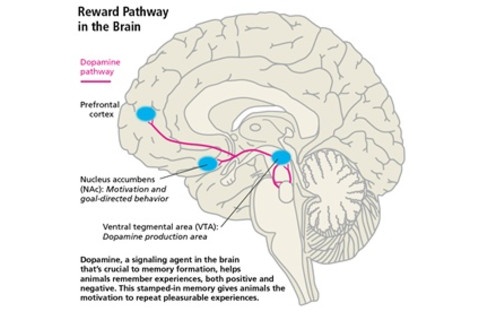
研究人员还表明,如果在大脑的多巴胺供应中心造成损伤,大鼠就会对安非他命失去兴趣。腹侧被盖区(VTA)和相关邻近区域,伏隔核(NAc),对多巴胺系统至关重要。明确证明并充实这一理论——被称为多巴胺假说——成为未来30年成瘾研究的关键。
到20世纪90年代中期,大多数成瘾研究人员开始相信多巴胺的作用比简单的快乐汁液更复杂。多巴胺作为一种学习信号,帮助动物记住愉快的经历并产生重复它们的动机。但这种信号在成瘾中不知何故出了问题。研究还表明,多巴胺需要存在才能让老鼠记住不愉快的经历,例如电击。当动物经历任何值得记住的强烈刺激时,大脑中会释放多巴胺。
“最近的文献中强调的一点是,多巴胺系统会被压力激活,”现在国家药物滥用研究所(NIDA)的怀斯说。“这些(压力源)并不令人愉快,但它们像愉快的经历一样有效地印刻在记忆中。多巴胺在这两种情况下都发挥作用。”
记忆与复发
成瘾最令人困扰的方面之一是复发。这不仅仅是成瘾克服了决心,即使复发会危及生计、人际关系和成瘾者的生命。这是使用药物的冲动在选择的药物离开成瘾者身体很久之后仍然存在。当找不到任何身体痕迹时,这种看不见的疾病的魔鬼如何持续存在?
对许多人来说,答案并不复杂:这就像品格不好、自私一样简单。但近年来,成瘾研究人员积累了越来越多的证据表明,成瘾是一种适应不良的学习形式,以某种方式永久地刻在大脑最原始的区域。研究人员长期以来怀疑,留下这种痕迹的化学工具是多巴胺。然而,要证明这一点,他们需要找到痕迹本身的证据。
为此,首先他们需要回答一个更基本的问题:如果成瘾是一种适应不良的学习和记忆形式,那么正常的学习和记忆是如何精确运作的?
这是加州大学旧金山分校(UCSF)两位研究员罗布·马伦卡(Rob Malenka)和罗杰·尼科尔(Roger Nicoll)实验室研究的核心问题。他们的工作在许多方面为如今席卷成瘾研究领域的革命奠定了基础。马伦卡和尼科尔知道,我们的记忆通过一个巨大的关联矩阵相互连接,神经科学家卡拉·沙茨(Carla Shatz)诗意地阐述了这一原则:“同时放电的细胞,就会连接在一起,”她写道。“不同步放电的细胞,就会失去连接。”换句话说,两个彼此靠近的神经元同时放电,就会以某种方式增强它们之间的连接。突触处的这种强化使它们更有可能在未来一起放电。
Alison Mackey/Discover
在20世纪90年代,马伦卡和尼科尔处于解开这种被称为长时程增强(LTP)现象背后精确化学过程的竞赛中心。解决这个谜团的关键在于理解信号如何在神经元之间传递。神经元只有当其膜内正负离子比率超过某个点时才会放电。要做到这一点,数百万个微小的带电离子必须通过专门的门控蛋白质进入细胞。
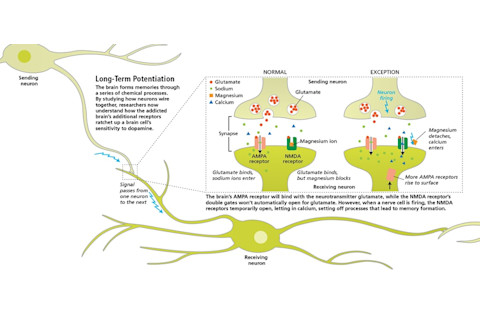
在海马体和杏仁核(被认为与情景记忆相关的大脑区域)中,研究人员已经表明,一种名为谷氨酸的化学信号传导剂就像一些蛋白质“闸门”的钥匙一样。马伦卡和尼科尔专注于AMPA和NMDA,这两种不同类型的神经元表面受体可以与神经递质谷氨酸结合。
AMPA受体在任何时候只要邻近细胞释放谷氨酸就会与谷氨酸结合。AMPA受体的通道将打开,正离子涌入细胞。但在正常情况下,NMDA受体就像一扇上了锁的门,门后还有一扇门。尽管谷氨酸可以与NMDA受体结合,但它本身不能打开NMDA受体的通道,因为通道通常被镁离子阻断。但也有例外。如果一个神经元已经放电,它的NMDA受体就会发生暂时性变化。在尖峰放电期间,镁离子将在所有突触处脱离。这个内部第二扇门的打开允许进入细胞内部。
NMDA受体的闸门结构与AMPA受体的不同。当NMDA闸门打开时,无法通过AMPA受体开口的钙离子会突然涌入神经元的内部。马伦卡和尼科尔认为,细胞内钙离子的存在就像一个细胞发令枪,引发了一系列复杂的化学过程,最终导致长时程增强(LTP)。

研究人员发现,在可卡因成瘾大鼠的大脑中,它们的渴望实际上会随着时间的推移而增加。异常受体出现在神经元表面,允许钙离子进入细胞。它们的大脑随后对寻求药物的线索变得更加敏感。Alison Mackey/Discover
Malenka 和 Nicoll 及其团队证明,当钙进入细胞并且新的 AMPA 受体移动到细胞表面时,就会发生 LTP。这些额外受体的存在使得细胞对未来邻居释放的谷氨酸更加敏感。
更重要的是,通过控制电刺激的时间,马伦卡和加州大学旧金山分校的研究人员明确证明,他们可以使更多的AMPA受体出现在接收神经元的外膜上——或者反之,使其消失。
Malenka 随后开始思考类似的机制是否也可能在成瘾中起作用,并开始了一系列实验,最终找到了确凿的证据。
2001年,加州大学旧金山分校的研究人员给小鼠注射了可卡因,释放出大量多巴胺。然后,他们从多巴胺生产中心的一组神经元中制备了小鼠大脑切片,在24小时后和此后的每一天进行检查。当他们仔细检查从吸食可卡因的小鼠大脑中取出的放大切片时,马伦卡和他的同事收集了微小的电记录,这些记录记录了一个神经元对其邻近神经元放电的反应。
他们的发现令新兴的成瘾研究领域振奋不已。最初的活动增强导致产生多巴胺的神经元对邻近神经元的额外刺激敏感度增加了一倍,持续数天,远在可卡因离开身体之后。直到10天后,所有变化的痕迹才消散。接下来,研究人员在引入可卡因时,给小鼠注射了一种药物,该药物阻断NMDA受体对邻近细胞信号的响应,结果没有发生这种敏感化。
这是首次证明,仅仅一次娱乐剂量的可卡因就可以劫持记忆和学习的基础机制——细胞间连接的强化。
“这是第一步——只是冰山一角,”现就职于斯坦福医学院的马伦卡回忆道。“成瘾是一种适应不良的记忆和学习形式。” 治愈线索
研究表明,大脑多巴胺产生区域(VTA)的变化——尽管对成瘾的发展至关重要——也引发了一系列生物学过程,导致伏隔核(NAc)的永久性变化,伏隔核是下游区域,与动机和目标导向行为密切相关。一些研究人员认为,大脑这个关键区域的这些变化可能有助于解释为什么成瘾者对自然奖赏失去兴趣。(成瘾还会导致大脑其他区域,如皮层和边缘系统发生变化,进一步影响这些行为。)
2008年,玛丽娜·沃尔夫(Marina Wolf),一位杰出的成瘾研究员,现任罗斯福富兰克林医学与科学大学芝加哥医学院神经科学系主任,研究了该领域的关键谜团:复发性复发现象,即使是那些决心戒除所选毒品的人也会遭受这种打击。沃尔夫和她的团队训练大鼠将鼻子伸入一个孔中,以接受静脉注射的可卡因,这会触发一个光线提示。在训练每只大鼠将光线与接受可卡因联系起来10天后,团队移除了可卡因管,等待一天,然后开始测量当灯亮时大鼠为了获得可卡因愿意付出多少努力。大鼠戳洞的次数越多,它获得可卡因的动机就越强,因此,它的渴望也就越强烈。
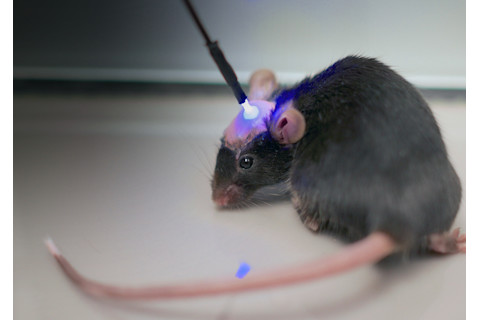
植入小鼠大脑的光导让研究人员能够刺激选定的神经元,然后研究细胞不同步放电的影响。Christian Lüscher
对于成瘾研究领域之外的人来说,这种动机的时机可能看似反常。但国家药物滥用研究所(NIDA)的研究人员表明,似乎存在一个潜伏期:渴望会减弱,但随后会出现戏剧性的渴望高峰。“对于那些摄入大量可卡因的老鼠来说,随着戒断期的延长,渴望反而会变得更强,而不是更弱,”沃尔夫说。类似的研究表明,“如果你出去一个月,向老鼠展示线索,渴望会更强烈。并在三个月时达到顶峰。即使六个月后,渴望也比第一天更强烈。”
的确,通过检查可卡因成瘾大鼠在不同戒断和渴望阶段的脑组织和切片,沃尔夫和她的同事发现,潜伏期和随后的渴望高峰似乎与伏隔核(NAc)神经元表面出现的非典型AMPA受体有关,这可能有助于解释可卡因渴望。这些非典型AMPA受体缺少一个关键的亚基,称为GluA2,它导致形状改变并允许钙离子进入细胞。结果,当动物看到线索并释放谷氨酸时,NAc神经元对线索的反应要强得多,大鼠表现出更强的渴望。但这种变化也带来了其他影响。由于钙离子通常只有在细胞已经放电时才通过NMDA受体进入细胞,因此非典型AMPA受体通过允许钙进入细胞,扰乱了大脑原始区域中学习和记忆的整个生化过程,而这些原始区域正是动机的源泉。
“改变伏隔核中学习发生的方式对生物体的[未来行为]来说是相当严重的事情,”沃尔夫说。
这种复发敏感期是反直觉的,但对于任何看到朋友成功戒烟、戒酒或戒毒几周,却又在看似已战胜心魔时莫名其发作的人来说,却是熟悉的。
“当我们在测试大鼠之前用药物阻断这些异常AMPA受体时,它们的渴望几乎恢复到正常水平,”沃尔夫说。
打开激光
沃尔夫2008年的论文让吕舍尔陷入沉思。是否有可能通过某种方式,通过人工刺激伏隔核(NAc),模仿大脑中记忆消退的方式来逆转这些变化?
吕舍尔向他的15人实验室团队提出了这个看似牵强的想法。他刚从斯坦福大学的半年休假回来,在那里他掌握了光遗传学技术。这项技术通过基因工程将光敏蛋白质(称为视紫红质)注入单个脑细胞,这些蛋白质会响应特定颜色的聚焦光(通过光纤传递)而打开并导致细胞放电——或停止放电。
到2011年,研究生文森特·帕斯科利开始了第一次实验。受“不同步放电的神经元,连接就会分离”这一理念的启发,吕舍尔指导帕斯科利尝试人工诱导已知会削弱两个神经元之间连接的化学反应。他们旨在证明,以每秒一次的电脉冲刺激一个突触10分钟会削弱连接。
之前的实验将可卡因成瘾与更多的寻药行为和对药物敏感性增加联系起来。衡量敏感性增加的一种方法是给小鼠注射可卡因,将小鼠放在圆形跑道上,并计算它绕跑道跑了多少次。更敏感的小鼠绕跑道的速度可能是首次注射可卡因的小鼠的两倍。
佛罗里达大学的外科医生使用制图软件规划电极插入患者大脑。Bob Croslin
为了他的光遗传学实验,吕舍尔将小鼠放在跑道上,计时它们的奔跑,喂食它们可卡因,然后将它们放回跑道。接着,他取下每只小鼠的大脑切片,测量神经元之间电量是否增加,这些神经元位于伏隔核和前额叶皮层之间。电量增加——因此推测小鼠对可卡因的敏感度增加——与小鼠在跑道上奔跑的速度完全一致。
当吕舍尔和他的团队重复实验时,他们在可卡因之后使用了光遗传学技术。他们在老鼠头骨上钻了微小的孔,将光纤穿过脑组织,直到到达伏隔核(NAc),那里的神经元已被基因改造,含有光敏门控蛋白。然后吕舍尔和他的团队通过光纤照射蓝光,选择性地刺激了一些神经元。受刺激的神经元放电,释放谷氨酸。但放电的低频率和释放的谷氨酸量不足以引起邻近神经元的放电。
换句话说,吕舍尔的方案创造了导致神经元“不同步放电”的条件,这使得它们“连接分离”。他希望这样做能导致AMPA受体从表面消失,从而削弱连接。
结果很清楚。当他们把小鼠放回迷宫并给它们可卡因时,它们的反应就像是第一次注射一样。成瘾敏感性消失了。
吕舍尔于2011年发表在《自然》杂志上的研究首次暗示,光遗传学可用于逆转长时程增强(LTP),从而使研究人员能够手动消除习得的行为。在2014年的一篇论文中,吕舍尔的团队证明,经过长时间训练自发注射可卡因的小鼠也作出了反应。这项方案不仅导致了缺陷AMPA受体的清除,而且当AMPA受体重新出现时,它们又恢复了正常。
尽管在他治疗过的小鼠身上可能仍然存在许多异常,但吕舍尔2011年的光遗传学论文是首批指出我们可能正在接近一种治疗方法,或者至少是针对成瘾的强大新干预措施时代的论文之一。2014年,沃尔夫和她的同事在老鼠身上发表了研究成果,表明可卡因成瘾者的复发也可以通过服用一种无毒的实验性化合物来预防,这种化合物可以导致钙渗透性AMPA受体在大约一天内消失,从而降低可卡因相关线索引发强烈渴望并导致复发的能力。
“这些化合物不会治愈成瘾。它们是戒瘾者在进入充满可能引发复发线索的环境之前可以服用以保持戒断的药物,”沃尔夫说。“但目前,可卡因成瘾者没有治疗方法,所以即使只是提供一天的保护也会有很大帮助。”
由于光遗传学被认为对人类来说过于侵入性,沃尔夫的技术比吕舍尔的技术具有明显的优势。但沃尔夫的方法也有一个缺点:注射的药物会扩散到整个大脑,不像吕舍尔的局部光遗传学方法,吕舍尔认为局部光遗传学方法也可能导致持久的变化。
吕舍尔知道,光遗传学要经过多年的改进才能应用于人类。相反,他专注于掌握DBS,这种技术使用电极刺激神经元群而不是单个脑细胞。吕舍尔说,尽管一些研究人员曾尝试在吸毒者大脑的不同部位使用DBS,并表示取得了有希望的轶事结果,但尚未进行大规模研究。而且这些实验者都没有以逆转可卡因或其他成瘾药物引起的突触变化为目的。
研究人员仍不确定深部脑刺激(DBS)在帕金森病患者身上为何精确有效。强烈的电活动爆发以某种方式使引起震颤的神经元处于静止状态。而这正是其他人试图应用于大脑不同部位以治疗成瘾的相同方案。
吕舍尔的方法从根本上不同。他大大减慢了脑细胞电刺激的节奏,以与他用光遗传学逆转成瘾所使用的激活节奏相匹配。与帕金森病中通过使神经元疲劳来暂时使其不活动不同,吕舍尔正在使用DBS重塑神经元之间的连接,因为“不同步放电的细胞,就会失去连接”。
DBS远不如光遗传学精确,其电极产生的电场更大,刺激的神经元也比必要的更多。但吕舍尔发现,如果他先给药暂时阻断神经元与多巴胺结合,然后再施用DBS,他就能复制他在小鼠光遗传学实验中发现的结果。
“这两者结合起来仍然不完全等同于光遗传学,但它确实能起作用,”吕舍尔谈到DBS和药物时说。“所以这是一种非常务实的方法,试图转化和模仿我们用光遗传学成功实现的目标。”
“从老鼠的光遗传学研究到在人类身上应用,仍然是一个漫长的过程,”吕舍尔一天早上坐在他的实验室里说。“我不确定这在我有生之年(作为科学家)是否会实现。但DBS是一个中间步骤。我对此感到乐观。”