一百多年前,一位德国医生对一位饱受痴呆症折磨的病人的大脑进行了一次可怕的尸检。他希望能揭示她严重而迅速的精神恶化和奇怪的情绪波动的生物学根源。
她名叫奥古斯特·迪特 (Auguste Deter),于 1901 年被送往法兰克福的精神病与癫痫医院。当阿尔茨海默首次采访这位 51 岁的妇女时,她陷入了迷雾般的困惑之中,并表现出妄想行为:她对丈夫嫉妒心极强;她有时会尖叫,以为有人要杀她;她变得狂野而无法控制。五年后她去世了。
当阿尔茨海默在显微镜下检查她大脑的薄切片时,他注意到,在健康神经细胞迷宫般的回路旁边,紧密地排列着一小团坚硬的、藤壶状的蛋白质束,称为淀粉样斑块,并且许多从神经细胞末端延伸出来的纤维——不同的蛋白质,称为 tau——变厚并缠结在一起。这种异常的大脑回路——即——成为了以他名字命名的疾病的双重标志。
多年来,科学家们一直努力了解这些蛋白质是如何运作的。它们为什么会这样?是斑块还是缠结先出现?哪一个是导致神经退化的罪魁祸首?是淀粉样蛋白是“坏男孩”,还是 tau 缠结?每个阵营都有其长期以来的支持者。但过去两年中,最新的技术进步和一系列引人注目的发现为阿尔茨海默病如何破坏大脑提供了关键线索。
尽管研究人员不愿说出“治愈”这个词,但他们已非常接近回答许多阻碍阿尔茨海默病研究的问题,并且他们正在寻找预防这种毁灭性脑部衰竭疾病的方法——或者至少减少其造成的损害。“在我们有生之年,我们将战胜阿尔茨海默病,”哈佛大学神经学家、波士顿马萨诸塞州综合医院神经退行性疾病研究所所长安妮·杨 (Anne Young) 说。“这是一个令人兴奋的时代,我们梦想的一切正在变为现实。”

德国医生阿洛伊斯·阿尔茨海默(Alois Alzheimer,左)在患者奥古斯特·迪特(Auguste Deter,右)的大脑中发现改变的蛋白质后,首次描述了以他名字命名的疾病。左:Jessica Wilson/Science Source。右:Phototake, Inc./Phototake
迫在眉睫的雪崩
超过500万美国人患有阿尔茨海默病,每年有50万人因此死亡。除非出现医学突破,否则随着全国7600万婴儿潮一代步入老年,预计将达到流行病级别。到2050年,全球阿尔茨海默病患者人数预计将达到1亿,其中美国多达1600万。如此巨大的护理需求将给社会带来难以承受的压力,并可能使医疗系统破产。
这场迫在眉睫的阿尔茨海默病“雪崩”使寻找治疗方法的工作更具紧迫性。2012年,奥巴马政府两年内拨款1.56亿美元资助研究,使总额达到每年5.3亿美元;目标是到2025年战胜阿尔茨海默病。这可能看起来雄心勃勃,但现在有理由相信这个目标可能触手可及。
到目前为止,寻找有效治疗阿尔茨海默病的方法一直以代价高昂且备受关注的失败为特征,这主要是因为我们没有专注于正确的靶点——而且我们介入得太晚了。科学家认为,当疾病显露其丑恶面目时,患者可能已经遭受了不可逆转的损害,这可能解释了为什么临床试验中测试的药物效果不佳。
但希望正在出现:科学家最近绘制出了许多阿尔茨海默病发展的神经通路。强大的新型高分辨率可视化工具可以深入观察活体大脑,使科学家能够追踪导致阿尔茨海默病的一系列事件。揭示了疾病的潜在生物学机制。解读这些叛逆 DNA 片段的工作原理可能会提供更多关于如何阻止疾病的线索。
这种对疾病的深入理解应该会带来更智能的疗法,而新的诊断工具可以在太多神经元被破坏之前进行干预。在不远的将来,“我们将能够根据遗传学识别出风险最高的人群,进行影像学检查以确定发病时间,然后实施早期干预疗法,”哈佛医学院神经学家鲁道夫·坦齐 (Rudolph Tanzi) 说。“这就是口号:早期预测,早期发现和早期干预。”
但阿尔茨海默症不会轻易泄露其秘密。
致命的连锁反应
我们现在知道,斑块是名为β-淀粉样蛋白肽的蛋白质片段簇。它们在大脑神经细胞外聚集,并扰乱神经元之间的信号系统,阻止它们传递信息。这种通讯中断解释了阿尔茨海默病患者为何会经历进行性记忆丧失、混乱和完成日常任务的难度增加。
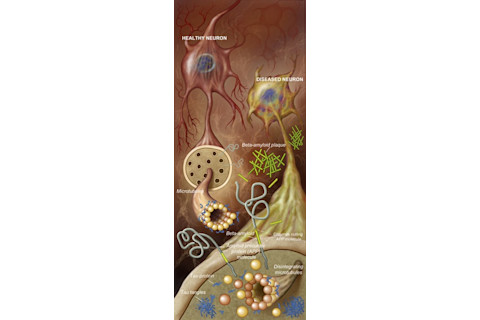
在一个被阿尔茨海默病摧毁的大脑中,对细胞通信至关重要的微管会随着tau蛋白(蓝色)形成缠结和淀粉样蛋白(绿色)形成斑块而分解。Jay Smith
相比之下,tau 蛋白在神经细胞内部造成破坏,导致意大利面状的缠结堆积,从而阻塞神经元。这会扰乱流经神经细胞的电信号流,最终导致它们萎缩和死亡。扭曲的 tau 沉积物堆积还会破坏周围的神经细胞,并最终使大片脑组织萎缩。其他重要的结构,轴突和树突——统称为神经突——从神经细胞伸出并发送和接收信息,都依赖于这个神经传输网络。当这个网络被 tau 缠结破坏时,它会引发大脑记忆和认知回路中的连锁反应损伤,加速精神退化。
淀粉样蛋白和tau蛋白都是天然存在的蛋白质。人体会产生淀粉样斑块,然后通过正常的生物衰变和更新过程将其清除。在某些情况下,淀粉样蛋白甚至可能起到保护作用;最近的研究表明,它们可以充当分子守护者,抑制身体的自身免疫反应。它们还会清除受伤后参与炎症的异常细胞。但由于尚未知的原因,当阿尔茨海默病发生时,这种蛋白质会异常分裂,产生一种称为β淀粉样蛋白的形式,这种形式对大脑中的神经元有毒。当这种情况发生时,大脑会产生斑块,这些斑块聚集在神经元周围,最终扰乱脑细胞之间的信号系统。
tau蛋白对神经元的结构完整性至关重要,它们就像支撑突触的横梁——突触是允许电脉冲在神经元之间传递的桥梁。但有时,tau蛋白也会出错,神经失去其结构支持,导致细胞崩溃和死亡。事实上,tau缠结可能是记忆丧失的真正罪魁祸首,因为它们与认知缺陷直接相关。人们可以有淀粉样斑块但仍能正常运作,但一旦他们出现tau缠结,痴呆症就显而易见了。
“缠结驱动痴呆症并驱动神经退化,”也是马萨诸塞州综合医院遗传学和衰老研究部门主任的坦齐说。“如果你没有缠结,你就不会得这种病。一旦缠结形成,它们就会像野火一样蔓延并持续蔓延。但我们理解中最大的漏洞是,淀粉样蛋白是如何驱动缠结形成的?”
科学家们正在通过基因指纹技术和允许研究人员观察斑块形成的技术。
窥探大脑内部
直到最近,观察人类斑块的唯一方法是分析死于该疾病的人的大脑——一位科学家将这一挑战比作观察一场车祸并试图找出事故原因。我们不能仅仅简单地剥开一个活人的头骨来实时观察发生了什么,也不能切下样本在显微镜下仔细检查。
尽管对阿尔茨海默病患者的尸检研究揭示了大量的斑块和缠结,但科学家们知道他们需要找出研究活体脑组织的方法才能揭开这种疾病的秘密。传统的成像技术,如核磁共振成像(MRI)和正电子发射断层扫描(PET)将不起作用。它们擅长提供小至毫米级的快照,并能告诉我们大脑活动,但它们无法捕捉到人脑斑块或缠结的形成,这些斑块或缠结大约有100微米,即十分之一毫米——大约是猫胡须厚度的两倍。
因此,直到最近,科学家们的大部分知识都是通过推断或研究疾病小鼠模型获得的。但这些实验动物并不是很好的替代品。然而,在过去的几年里,强大的新型可视化工具,再加上能够照亮最微小脑组织的示踪化学品,让科学家们得以一窥人脑的内部运作。
2012 年,FDA 批准了 Amyvid,这是一种放射性染料,它能附着在淀粉样蛋白上,因此可以在 PET 扫描上突出显示它们。类似的放射性示踪剂也已投入使用。将此类化学品与多光子共焦显微镜等相结合,使研究人员能够探索神经元的微小世界,并以更高的精度观察脑细胞的活动。这种显微镜功能强大,足以检测小至一微米(千分之一毫米)的物体,而斑块约为 10 微米。
“你可以看到神经元之间的单个连接,并实时观察斑块形成图像,”哈佛医学院神经学家布拉德利·海曼说。
追踪叛逆DNA
利用这些新的成像工具,科学家们现在可以追踪与阿尔茨海默病相关的错误基因的行为。尽管阿尔茨海默病中的神经退化是一个复杂的过程,历时多年,但其触发事件可能仅由少数几个出错的基因引起。这些叛逆的 DNA 片段是研究目标。
阿尔茨海默病会影响几代人的家庭。在早发型病例中,它夺走了正值生命鼎盛时期(四五十岁)的患者的生命。它将他们笼罩在困惑的迷雾中,最终侵蚀了人际关系和记忆。科学家们在过去三十年中,大部分时间都在寻找与这种遗传性疾病相关的基因。在过去三年中,他们发现了十多个。
发现阿尔茨海默氏症背后的突变DNA片段,可能很快就能通过基因检测,判断某人是否处于较高风险,从而采取预防措施。这些发现还能告诉我们疾病的进展情况。
“每当你发现一个基因,你就拥有了一个新的工具,它能让我们深入了解疾病的潜在机制,”宾夕法尼亚大学病理学家、阿尔茨海默病遗传学联盟(由来自44所大学和研究中心的调查员组成的合作组织)主席杰拉德·谢伦伯格说。
史黛西·詹尼斯/阿尔茨海默病协会
在过去十年中,谢伦伯格花了大量时间打电话劝说同事做一些他们通常不会做的事情:汇集数据,而不是为了突破性发现而热切地囤积数据。他多年的温和劝说最终促成了该联盟的成立,该联盟收集了超过11,000名阿尔茨海默病患者和几乎相同数量的没有痴呆迹象的老年人的遗传数据。
研究人员利用基因分型来确定遗传差异,并开始发现模式。他们识别出四种在患有该疾病的人群中更常见的基因。当来自美国和欧洲的另外三个研究小组添加了他们的患者资料,使总人数增至54,000人时,他们的发现得到了证实。新发现的基因在三种不同的身体功能中发挥作用,包括控制炎症和胆固醇的系统,以及调节脑细胞如何清除有毒蛋白质。这些发现建立在之前关于与阿尔茨海默病相关的基因(如APOE-4基因)的发现之上,APOE-4基因是迟发性阿尔茨海默病的一个强大标志物;约40%的诊断患者携带这种DNA变体。
2013 年秋季,这个国际联盟又识别出 11 个增加阿尔茨海默病风险的基因,使与该病更常见的迟发型相关的基因总数达到 21 个。这一扩大的基因集合有助于更清晰地描绘出增加风险的因素。它还提供了前所未有的机会,一窥驱动该疾病的生物学途径。
一些新发现的基因调节脑部记忆中心(如海马体)中神经细胞的相互交流;另一些则与免疫反应和炎症有关。这一发现进一步支持了越来越多的证据表明,炎症——以及我们免疫系统在清除异常斑块和缠结留下的细胞碎片时过度活跃的反应——在疾病的传播中起着关键作用。“我们开始将基因与临床症状联系起来,”参与这项工作的坦齐说。“斑块和缠结启动了这一过程,神经细胞开始死亡。但直到炎症开始,这一过程才会像野火一样蔓延开来——这就是导致痴呆症的原因。”
最近的研究也阐明了导致大脑萎缩的致命级联反应是如何启动的:淀粉样斑块的积聚,与某些基因突变协同作用,引发了叛逆tau蛋白的形成。但具体是哪些基因呢?为了找出答案,Tanzi正在研究3000个家庭的DNA,这些家庭中有多个成员患有迟发型疾病。希望是能够识别出许多(如果不是全部)其他影响风险的基因和基因突变。
攻击计划
但真正的重头戏在于精确解读这些基因的作用,并用这些零碎的信息拼凑出一个更全面的图景,以揭示基因变异如何导致破坏。2013年一项惊人的发现可能包含了一个关键的谜题,有望开发出能够阻止疾病进展的疗法。
这始于2008年,当时哈佛大学的研究人员在一项针对受阿尔茨海默病影响家族的基因组范围内筛选中发现了CD33基因。当时,他们尚未确定该基因的功能。但在对迟发性阿尔茨海默病患者脑组织的尸检分析中,科学家们注意到,在称为小胶质细胞的细胞中,CD33基因过多,这些细胞由免疫系统派出以抵御外来入侵者。CD33的存在与破坏性淀粉样斑块的数量之间似乎存在直接关系。
通常,这些小胶质细胞是有益的。它们清除分子碎片,例如死亡和垂死的神经细胞以及可能损害脑功能的粘性淀粉样蛋白沉积物。但是,小胶质细胞处于高度警惕状态,并在出现问题的第一时间采取行动。不知何故,当小胶质细胞携带有异常CD33时,它们会过度活跃,发起不加区分的搜索和破坏任务,当过多的淀粉样蛋白开始堆积时,它们会用“友军火力”扫射健康的神经元。
“当神经元死亡时,小胶质细胞并没有进行清理,而是当它们看到过多的细胞死亡时,就认为自己受到了攻击,并作为附带损害杀死神经细胞,”领导该研究团队的坦齐说。“现在很清楚,CD33是触发小胶质细胞从神经保护功能转变为神经毒性功能的主要开关。”他相信,找到一种化合物来阻断这个“叛逆”基因并将其关闭,可以阻止淀粉样蛋白造成的损害。
2013年秋季,谭子团队做出了一项被誉为“范式转变”的基因发现,有助于解决关于淀粉样蛋白还是tau蛋白引发迟发性阿尔茨海默病的争论。在对新开发的、能很好地模拟阿尔茨海默病的小鼠进行实验后,他们发现一种名为ADAM10的基因能产生一种名为α分泌酶的酶,这种酶能阻止β淀粉样蛋白的形成。但ADAM10基因的突变形式却恰恰相反:它削弱了酶的作用,导致产生更多的有毒蛋白质。“患有这种基因突变的人通常在70岁左右患上阿尔茨海默病,因为保护酶活性降低导致淀粉样蛋白堆积,”谭子说。研究人员现在正在实验室中测试这些酶的调节剂,以期修复这种缺陷并阻止斑块的产生。
但并非只有“坏家伙”被揪出。研究人员还发现了一些 DNA 片段,它们似乎能够阻止这种脑部疾病的发展,即使是在那些基因使他们面临更高风险的人群中。冰岛科学家在研究其 1,795 名公民的 DNA 时,发现了一个罕见的异常基因——欧洲血统中只有万分之一的人携带这种突变——它能减缓大脑中斑块的产生。他们发现,85 岁或以上且没有阿尔茨海默病——或任何精神敏锐度下降——的人携带这种突变基因的频率是患病者的四到五倍。研究人员发现尤其令人惊讶的是,即使是那些携带两份 APOE-4 基因(在 80 岁阿尔茨海默病患者中约 90% 存在)的八旬老人,情况也是如此。大约 25 名 85 岁以上的人携带两份 APOE-4 基因,但他们中没有一人患有这种疾病。
下一步是弄清楚这种保护性突变基因是如何工作的,然后开发出一种模仿其作用的治疗方法。实现这一壮举将代表着向真正治愈迈出了一大步。“该基因已被克隆,我们知道它会干扰有毒淀粉样蛋白片段的产生,”纽约大学医学院精神病学和细胞生物学教授、阿尔茨海默病协会医学和科学咨询委员会前主席拉尔夫·尼克松说。“但我们不知道它具体的作用机制——这正是需要完成的工作。”
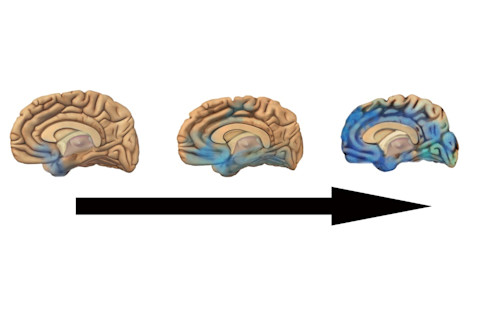
斑块和缠结以可预测的破坏模式扩散到整个皮层。美国国家老龄化研究所/美国国立卫生研究院
治疗前沿的希望
阿尔茨海默病遗传学破译的进展不仅能找出更可靠地预测风险的常见DNA变异,还能为预防、阻止甚至逆转疾病的潜在生物靶点提供新线索。迄今为止,大多数有希望的治疗方法都已半途而废。制药公司在阿尔茨海默病疗法上损失了数十亿美元,这些疗法在早期研究中表现良好,但在更大规模的临床试验中失败,导致一份报告将该领域描述为“希望的墓地”。
但是这些治疗方法是在已经出现疾病症状的人身上进行测试的。最近对患有遗传性早发性阿尔茨海默病的人进行的研究发现,早在症状出现前长达二十年就存在异常淀粉样蛋白,这表明我们干预得太晚了,那时损害已经无法修复。
“这导致人们开始寻找那些因遗传而注定会患阿尔茨海默病的人,并在他们出现症状之前就识别他们,”尼克松说。“然后我们就可以在疾病变得像一辆无法停止的火车之前进行治疗。”
在过去几年中,启动了两项研究,旨在找出能够缩小斑块的药物是否能在那些基因易感阿尔茨海默病的人群中,在症状出现之前阻止疾病发作。其中一项研究被称为 DIAN(显性遗传阿尔茨海默病网络),涉及美国、英国、德国和澳大利亚的 260 多人。另一项研究是阿尔茨海默病预防倡议,包括生活在哥伦比亚麦德林及其周围山区村庄的约 5,000 名大家庭成员中的 300 人。
DIAN 研究由患有遗传性早发性阿尔茨海默病的家庭组成;许多亲属患有该病或死于该病。携带突变基因的人有时在三四十岁时就会出现症状,通常与他们父母开始出现症状的年龄相同。平均而言,大多数人在45岁之前出现症状,并在51岁时被诊断出痴呆症。没有人能逃脱这种携带这种异常DNA的悲惨命运。
DIAN 参与者被给予两种药物之一,分别为甘特那班(gantenerumab)和索拉珠单抗(solanezumab)。两者都是抗体,它们与淀粉样蛋白结合,并帮助在这些有毒蛋白有机会形成斑块之前将其从大脑中清除。在针对哥伦比亚家族成员的早发性阿尔茨海默病研究中,科学家们正在测试另一种药物 crenezumab,其作用与其他药物类似。如果这些疗法能以某种方式阻止或减缓记忆丧失、混乱或斑块形成的进展,那么就有可能减缓疾病的进展。
由于这些备受关注的研究中的受试者风险极高,研究人员应在未来几年内知道实验性药物是否会阻止或延迟疾病的发作。“对这些家族的特征描述非常全面,基于他们所有的兄弟姐妹和父母,我们知道任何一个人何时会开始出现认知缺陷,”总部位于印第安纳波利斯的礼来公司(Eli Lilly and Co.)阿尔茨海默病研究员罗纳德·德马托斯说。礼来公司生产solanezumab并共同赞助DIAN试验。“如果他们在该时间范围内进展得比平时慢,那将表明这些治疗正在产生其预期的效果。”
但是那些没有强烈家族病史的人呢?去年,另外两项长期临床试验开始测试可能预防或延缓阿尔茨海默病在健康志愿者中发生的疗法,这些志愿者没有遗传性早发性阿尔茨海默病的风险。其中一项研究名为 A4(无症状阿尔茨海默病抗淀粉样蛋白治疗试验),将在 1,000 名认知正常的 65 至 85 岁人群中测试索拉珠单抗,这些人群淀粉样蛋白水平异常高。参与者将根据 PET 脑部扫描的结果进行选择,以检测异常蛋白质的存在。
另一项试验,名为“明日研究”,将给健康的志愿者服用 FDA 批准的糖尿病药物吡格列酮,以观察它是否能延缓认知障碍的最初症状。这项临床试验最终将纳入 5000 名携带有两种与阿尔茨海默病相关的特定基因(APOE 和 TOMM40)的参与者。德国科学家在 2014 年进行的一项观察性研究表明,长期使用这种药物可能有助于预防痴呆症。他们利用德国数据库中的处方信息,调查了 14.5 万名 60 岁或以上未患痴呆症的成年人。六年后的随访中,他们发现该队列中 10% 的人(约 1.4 万人)患上了痴呆症,但在服用糖尿病药物的人群中,风险较低。“糖尿病患者患阿尔茨海默病的风险可能会增加,”阿尔茨海默病协会科学项目和外展主任基思·法戈说。“这种药物可能通过控制葡萄糖代谢和其抗炎作用来降低这些风险。许多研究人员现在认为炎症在阿尔茨海默病中起着重要作用。”
此外,坦齐领导的一个研究团队取得了一项新进展,他们“在培养皿中”制造出了所谓的“阿尔茨海默病”。该团队利用人类胚胎干细胞(可以转化为体内任何细胞),并将其在化学混合物中培养,以生长出人类脑细胞。然后,他们将阿尔茨海默病基因植入神经元,这些神经元也随之开始产生该疾病的特征性团块和缠结。
“六周内,神经细胞产生了淀粉样蛋白,八周内,我们得到了缠结,”Tanzi 说。“这比我们现有的模型好得多,而且更快、更便宜。我们现在可以在两个月内筛选出培养皿中的药物。”
这一发现将解决制定疗法的一个关键障碍:缺乏一个能够阐明疾病进展情况的人体模型。科学家将这一进展描述为“游戏规则改变者”,可以极大地加速新药候选物的测试。
疾病的进展可能需要多种策略相结合才能停止,就像艾滋病和许多癌症现在所治疗的那样,采用针对不同靶点的药物组合。
“我们一直都在假设一种药物就能解决所有问题,扭转缺陷,”加州大学欧文分校记忆障碍和神经疾病研究所所长弗兰克·拉费尔拉说。“但这就像试图用一桶水去扑灭熊熊大火。一旦火势达到那种程度,你就需要出动消防车和直升机。”
阅读更多