本·巴雷斯的大脑模型放在斯坦福大学医学院他办公桌后面的窗台上。对于一个普通的观察者来说,这个由核磁共振扫描3D打印出来的塑料块没有什么特别之处。它几乎湮没在神经生物学家办公室里堆积如山的文件、咖啡杯、奖牌和奖杯中,丝毫没有透露巴雷斯真正的大脑所帮助完成的事情:彻底改变了我们对大脑的普遍理解,以及它们如何出错。
巴雷斯是胶质细胞研究领域的先驱。这类细胞构成了人脑的90%,但受到的关注远少于神经元——以闪电般的速度传递我们的思想和感觉的神经细胞。胶质细胞长期以来主要被视为一支维护队伍,执行着输送营养、清除废物等不起眼的任务,偶尔在脑部受损或感染时进行防御。然而,在过去的二十年里,巴雷斯的研究揭示,它们实际上在塑造发育中的大脑以及指导神经元在生命各个阶段的行为方面发挥着核心作用。
“他一个接一个地做出了令人震惊的革命性发现,”伦敦大学学院名誉教授、生物学家马丁·拉夫说,他自己的工作为这些进展铺平了道路。
最近,巴雷斯和他的合作者们取得了一些发现,可能彻底改变从青光眼和多发性硬化症到阿尔茨海默病和中风等神经退行性疾病的治疗。他们的发现表明,驱动这些疾病的是一个胶质细胞从滋养神经元转变为破坏神经元的过程。旨在阻止这种变化的药物的人体试验刚刚开始。
他大脑的3D打印模型放在斯坦福大学的办公室里。(图片来源:本·巴雷斯)
本·巴雷斯
“我希望我能活到看到结果的那一天,”巴雷斯说。去年,61岁的他被诊断出患有胰腺癌。这种疾病的五年生存率仅为8%。多亏了积极的化疗、免疫疗法和放疗(以及各种药物来抵消副作用),他感觉身体状况良好,现在每天都能去实验室。尽管如此,他仍在为早逝的可能性做准备。他计划在他不再使用大脑时将其捐赠用于解剖,并争分夺秒地解决至少几个剩余的胶质细胞之谜。
巴雷斯身材矮小,秃头,留着稀疏的胡须,戴着无框眼镜,穿着工装短裤,他平静得出奇地追溯着引领他取得突破的道路。“我真的不太担心死亡,”他说。“令人沮丧的是,有那么多我无法继续研究的事情。有那么多我想知道的事情。”
困于“神经胶”
关于巴雷斯大脑的一件事是,它出生在一个女性身体里,但一直认为自己是男性。尽管变性者的生物学基础仍然未知,但巴雷斯怀疑在他的案例中,原因是他母亲服用了一种睾酮样药物来预防流产。他的异卵双胞胎妹妹显然没有受到影响。然而,巴雷斯从蹒跚学步时就坚持玩卡车而不是玩洋娃娃。他——或者她,因为年幼的芭芭拉被指定为女性——讨厌穿裙子,渴望加入小童子军。6岁时,她进一步违反了那个时代的性别规范,决定长大后要成为一名科学家;很快,她就开始捣鼓化学实验和望远镜。
巴雷斯的父母,新泽西州西奥兰治的一名推销员和一名家庭主妇,只是把她看作一个假小子。但其他人认为她是个怪人。“我小时候很孤独,但我从未真正因此感到不快乐,”巴雷斯回忆说。总有实验要做,有机器要拆解。八年级时,她把目标锁定在麻省理工学院。尽管她的高中辅导员劝阻她——1972年的麻省理工学院招收的女生很少,即使像巴雷斯那样是数学队队长——她还是被提前录取了,成为她家中第一个上大学的人。
在那里,由开创性神经心理学家汉斯-卢卡斯·托伊伯(Hans-Lukas Teuber)教授的一门课程激发了巴雷斯对大脑的兴趣。获得生命科学学士学位后,她进入达特茅斯学院医学院,随后在纽约市威尔康奈尔医学中心进行神经病学住院医师培训。在她的神经病理学轮转期间,她遇到了一个被称为神经胶质增生的现象,它发生在每种类型的急性或慢性中枢神经系统损伤中。胶质细胞在受损区域增殖并改变形状,发出复杂的化学信号阵列。透过显微镜,巴雷斯被迷住了。“这意味着什么?”她想知道。当时,没有人能说清楚。
(图片来源:designua/Shutterstock)
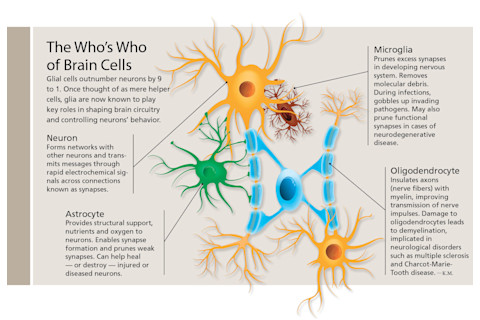
胶质细胞最初于1856年由德国病理学家鲁道夫·魏尔肖命名;他认为它们的功能是固定神经元,因此将它们命名为神经胶质(neuroglia),即“神经胶水”。到20世纪20年代,科学家们已经确定了三种基本类型:星形胶质细胞,因其星形而得名;小胶质细胞,表面覆盖着树枝状突起;以及少突胶质细胞,它们的触角将它们固定在神经纤维或轴突上。
在巴雷斯接触胶质细胞时,研究人员已经知道少突胶质细胞用被称为髓鞘的脂肪绝缘层包裹轴突。他们怀疑小胶质细胞(像身体中的一些免疫细胞一样)吞噬分子碎片和任何穿过血脑屏障的病原体。星形胶质细胞为神经元提供营养并清除它们的废物。但关于胶质细胞的更多方面仍然是神秘的。例如,在胶质增生期间,星形胶质细胞与神经损伤的愈合和恶化都有关联。科学家们不确定它们是有益还是有害。胶质细胞如何相互沟通,或与神经元沟通,也不清楚。
能够回答这些问题的先进工具刚刚问世,使研究人员能够测量基因活性并利用实验室制造的分子探测细胞功能。但由于胶质细胞缺乏神经元传递快速神经冲动的能力,并且被认为在健康大脑中处于静止状态,因此很少有科学家认为它们值得研究。
然而,巴雷斯习惯于走自己的路。1983年,她追随自己对这些被忽视的细胞的好奇心,进入哈佛医学院的神经生物学博士项目。她的导师大卫·科里——尽管他自己不是胶质细胞专家——对她的才华和进取心印象深刻,鼓励她进行探索。他还敦促巴雷斯联系伦敦大学学院的拉夫。几年前,拉夫已经确定了某些免疫细胞的表面蛋白(这是理解它们结构和行为的第一步),现在正试图对胶质细胞做同样的事情。当拉夫从伦敦飞来发表演讲时,两人交换了意见,并最终保持了跨大西洋的通信。
作为一名研究生,巴雷斯成为利用现有方法研究胶质细胞的专家。她还设计了一些重大的技术改进,并发表了几项开创性研究。巴雷斯是首批证明胶质细胞拥有自己的电化学信号生成机制,以及神经递质受体——这些都是关于它们如何发送和接收信息的关键线索——的研究人员之一。
1990年,巴雷斯作为拉夫的博士后去了伦敦。“她非常非常聪明,”这位现年79岁的著名生物学家回忆道,“她工作比我认识的任何科学家都努力。她偶尔会在我的小办公室睡觉,早上我开门时会拍她的头。”在大学学院,巴雷斯继续发表论文,阐述胶质细胞生理学(特别是少突胶质细胞发育)的复杂性,并创造了提取和培养她痴迷的脆弱物体的新技术。
终于协调一致
巴雷斯于1993年来到斯坦福大学,担任助理教授,并拥有自己的实验室。她对自己的工作很满意,但生活在错误的性别中的压力越来越难以忍受。“我经常想自杀,”巴雷斯说。尽管她的外表是中性的——短发、T恤、牛仔裤——她从未向任何人吐露过自己感觉像个男人。“这似乎是个奇怪的话题。那时互联网几乎不存在。我甚至不知道‘跨性别’这个词。”

(图片来源:马西奥·何塞·桑切斯/美联社)
马西奥·何塞·桑切斯/美联社
此后不久,巴雷斯在《科学》杂志上发表了他迄今为止最重要的研究。该研究表明,在没有胶质细胞的情况下培养的神经元形成的突触(神经冲动通过的连接)更少,并且出现的突触并未完全发挥作用。这是最早的有力证据之一,表明神经元需要来自胶质细胞的信号才能发挥功能。
巴雷斯于1997年获得了终身教职。那年秋天,她偶然读到一篇报纸文章,让她震惊不已:一个病人在帕洛阿尔托一家诊所接受了从女性到男性的性别重置手术的故事。“那是我第一次知道还有人像我一样,”巴雷斯说。在咨询了几位亲密同事之后,她决定迈出这一步。她开始服用荷尔蒙,并发出了一封邮件,宣布她 henceforth 将以男性的身份生活。43岁时,芭芭拉变成了本。
“这有点吓人,”他承认。“学生们还会想加入我的实验室吗?我还会被邀请参加会议吗?我还会拥有职业生涯吗?”但在他变性后的20年里,他说,“我遇到的每个人都非常支持我。”
“他给了很多建议,但把我们当作平等的,”神经生物学家卡格拉·埃罗格卢谈到巴雷斯时说。“他教导我们要成为独立的思考者。”
巴雷斯很快升任正教授,然后是系主任。他招募了雄心勃勃的博士后和研究生,而且由于没有家庭生活分散他的注意力——他从未真正被任何人吸引过——他把他们编织成了一个临时的家庭。有晨间骑行和深夜的闲聊。巴雷斯是个咖啡狂,会把一袋袋自己烘焙的咖啡豆扔给那些在实验台旁辛勤工作的人。“如果他饿了,他就会在你的抽屉里翻找零食,”现杜克大学神经生物学家卡格拉·埃罗格卢回忆道。
巴雷斯也将指导作为优先事项。“他给了很多建议,但他把我们视为平等的,”埃罗格卢说。“他教导我们成为独立的思考者,并独立管理项目。”他经历过性别鸿沟的两边,因此特别关注女性研究人员面临的挑战。2005年,时任哈佛大学校长拉里·萨默斯暗示,科学界女性的缺乏反映了“内在能力”的差异后,巴雷斯在《自然》杂志上发表了一篇反驳文章,不仅引用了学术研究,还引用了他作为芭芭拉的亲身经历:有一次一位教授指责她从男朋友那里得到了一个难题的答案;有一次她输给了一个远不如她的男性,失去了一项奖学金。他写道,变性后,“我甚至可以在不被男人打断的情况下完整地说完一句话。”
失控的细胞
巴雷斯的门生们开始在他的突破性研究基础上继续发展。一个关键的进展涉及一种名为C1q的蛋白质,它是免疫系统经典补体级联过程的一部分。在体内,C1q标记患病的细胞和病原体,以便免疫细胞吞噬它们。人们认为它根本不会出现在大脑中。但巴雷斯在神经元发育早期在健康神经元中发现了C1q:星形胶质细胞刺激了这种蛋白质的产生。研究人员早就知道,为了建立成熟的神经回路,幼年动物体内多余的突触必须被修剪掉。然而,这个过程的细节仍然模糊不清。巴雷斯想知道C1q蛋白质是否帮助触发大脑内的免疫细胞——小胶质细胞——进行修剪。他实验室里的一位年轻研究员贝丝·史蒂文斯(Beth Stevens)开始着手调查。

贝丝·史蒂文斯,现任波士顿儿童医院神经学助理教授,继续与她的导师巴雷斯合作。(图片来源:约翰·D·和凯瑟琳·T·麦克阿瑟基金会)
约翰·D·和凯瑟琳·T·麦克阿瑟基金会
2007年,史蒂文斯和巴雷斯发表了一项研究,表明答案是肯定的。他们专注于大脑视觉中心的一部分。缺乏功能性C1q生产基因的小鼠在该视觉区域显示出修剪不足。此外,在正常小鼠中,C1q仅在动物发育期间集中在突触处,此后几乎消失。这提出了一个有趣的问题:神经退行性疾病是否可能是由于这种修剪过程被错误地重新开启而导致的?作者指出,在几种此类疾病中,C1q生产基因被激活。他们推测,失控的星形胶质细胞可能用这种蛋白质覆盖无辜的突触,将它们标记为小胶质细胞进行不必要的清除。为了验证这一假设,该团队检查了被培育出青光眼的小鼠,在这些小鼠中,视神经的神经元会缓慢死亡。正如预期的那样,在细胞萎缩之前,C1q出现在突触处。
进一步的实验证实了研究人员的直觉,即修剪是由小胶质细胞完成的,无论是在发育过程中还是在神经退行性疾病中,并且C1q和其他补体蛋白发挥着关键作用。2011年,巴雷斯共同创立了一家名为Annexon Biosciences的公司,以开发基于这一概念的药物。
巴雷斯团队随后的研究为胶质增生带来了新的见解,这是最初引发他对胶质细胞迷恋的神经损伤反应。由詹妮弗·扎马尼安(Jennifer Zamanian)领导的研究人员发现,星形胶质细胞根据威胁的类型,以至少两种不同的方式对损伤作出反应。当小鼠大脑被注射一种产生感染中常见炎症的物质时,星形胶质细胞会激活控制补体蛋白的基因——这种反应后来被称为A1。当大脑受到中风(血液供应中断)造成的损伤时,星形胶质细胞会增强控制一系列有助于神经元生长和存活的肽和蛋白质的基因活性——这种反应被称为A2。由于补体蛋白与突触损失相关,而其他肽和蛋白质与突触生长相关,研究人员提出,A1星形胶质细胞可能有害,而A2星形胶质细胞可能有利。
当由巴雷斯的另一位门生钟元硕(Won-Suk Chung)领导的研究人员发现星形胶质细胞也可以自行吞噬突触,而无需通过C1q将工作分包给小胶质细胞时,情况变得更加复杂。事实上,钟的团队发现,星形胶质细胞的修剪一直持续到成年;他们推测,在健康的大脑中,这种持续的过程可能有助于学习和记忆。
2016年3月,史蒂文斯——现在她在波士顿儿童医院运营自己的实验室,并在哈佛医学院任教——与巴雷斯团队合作,在《科学》杂志上发表了一篇论文,首次证明C1q至少部分导致阿尔茨海默病中异常的突触丢失。该研究报告称,在培养出过量淀粉样蛋白(与阿尔茨海默病相关的废物蛋白)的小鼠中,高水平的C1q触发小胶质细胞吞噬功能性突触,远早于斑块或认知症状的出现。小胶质细胞只有在淀粉样蛋白和C1q同时存在时才会攻击突触,这表明这些元素共同驱动了与疾病相关的突触丢失——这与广泛认为淀粉样斑块是罪魁祸首的观点相矛盾。最有希望的是,当给小鼠注射阻断C1q的抗体时,更多的突触得以保持完整。
然而,对巴雷斯来说,另一个发展占据了中心地位。论文上线前一周,他凌晨3点醒来,胸口剧痛。是心脏病发作。他驱车前往急诊室,医生救了他的命。随后的检查揭示了病因:胰腺有一个巨大的肿瘤,并且已经扩散到肝脏。
无悔
在他被诊断出疾病的第二天,“本尽可能努力地为实验室里的所有人制定过渡计划,以确保在他去世的那一天,他们能有一个安全网。他的首要想法是尽力帮助他们,”斯坦福大学神经生物学家汤姆·克兰迪宁(Tom Clandinin)回忆道,他接任了系主任。
巴雷斯也一直在探索胶质细胞的秘密。有时,尤其是在化疗输液之后,他太累了以至于无法下床,所以他就在床上工作。但几乎每天早上,他都会来实验室——而且他常常比其他人待得更晚。“他激励着我们所有人,”史蒂文斯说,“他是一种自然的力量。”
关于巴雷斯肿瘤的好消息是,它是由BRCA2突变引起的,这与他(和他的母亲)乳腺癌的遗传缺陷相同。晚期BRCA2胰腺癌通常比其他类型对治疗反应更好;中位生存期约为两年,而不是六个月。巴雷斯的肿瘤和转移瘤逐渐缩小。十月,他去毛伊岛参加了一个会议。十一月,他被授予拉尔夫·W·杰拉德奖,这是神经科学学会颁发的最高荣誉,这进一步提振了他的精神。
1月份,他的博士后沙恩·利德洛(Shane Liddelow)领导的一项研究在解释星形胶质细胞如何转变为破坏性A1细胞方面取得了巨大进展。这次,是小胶质细胞发出了指令。当利德洛的团队向小鼠大脑注射一种存在于细菌细胞壁中的化合物时,小胶质细胞会增加C1q以及另外两种促炎蛋白——TNF-α和白细胞介素-1α——的产量。这些物质各自对静止的星形胶质细胞具有部分A1诱导作用。当它们结合在一起时,就变成了完全的刺客,能够削弱或杀死其他细胞。
该团队发现,A1星形胶质细胞会分泌一种不明毒素。在低浓度下,它会干扰突触的形成和功能。在较高水平下,它会触发多种神经元以及少突胶质细胞(产生髓鞘的胶质细胞,其丢失会导致多发性硬化症)的自毁。研究人员在多发性硬化症、阿尔茨海默病、帕金森病、亨廷顿病和肌萎缩侧索硬化症患者的脑组织中观察到A1星形胶质细胞簇,这表明这些星形胶质细胞可能有助于推动神经退行性疾病的发展。但是,通过用针对所有三种触发蛋白的抗体处理星形胶质细胞,可以完全阻止A1的形成。今年3月,Annexon启动了C1q阻滞剂的人体安全性试验。利德洛计划今年秋天在纽约大学成立自己的实验室时,继续进行他的杀手级星形胶质细胞研究;他的下一步是确定A1星形胶质细胞释放的毒素。另一个悬而未决的问题是这种中毒过程如何与巴雷斯和史蒂文斯关于错误小胶质细胞破坏突触的发现联系起来。巴雷斯说,渴望看到这些研究的结果,“这才是现在真正让我活着的动力。”
然而,无论他还有多少时间,他都认为自己是一个幸运的人。巴雷斯说他永远不会忘记他实习时治疗过的一个病人,一个六十多岁的男人,刚刚被诊断出癌症。“他抓住我说,‘我必须告诉你一件事。我一生都在努力工作——白天、晚上、周末。我以为没关系,因为我65岁就可以退休享受生活了。不要犯我犯的错误。’”
“我完全没有理会他,”巴雷斯笑着说。“但我一点也不后悔。我还会以完全相同的方式做这一切。”
肯尼斯·米勒 是《发现》杂志的特约编辑。他之前在该杂志上发表的文章是关于癌症免疫学研究员詹姆斯·艾利森的。
[本文最初以“本·巴雷斯的大脑”为题发表在印刷版上。]
















