半透明的精子在泛黄的笔记本电脑屏幕上缓慢蠕动。胚胎学家告诉我,它们通常速度更快,但这些小家伙们正艰难地穿过一种能减慢它们速度的黏稠液体。这样它们就更容易被捕捉。
一根细长的中空针从屏幕右侧进入,靠近一个游动的精子。设备将其从尾部吸入,精子细小的圆形身体在透明的精子真空管中清晰可见。
屏幕切换到新画面。精子消失了,取而代之的是更大、自由漂浮的卵子。人类卵子。
另一件仪器出现在屏幕上,轻轻地推动一个卵子,使其像被轻轻碰撞的沙滩球一样漂浮开。又试了一次,这根手指状的装置成功地抓住了卵子,用温和的吸力将其固定住。
这场演示的制作人是研究员努里亚·马蒂-古铁雷斯(Nuria Marti-Gutierrez),她坐在屏幕附近的显微镜旁,目光紧盯着她的目标,双手在半打的旋钮和表盘之间操作。她正在进行的整个过程肉眼无法看见。这些操作都在显微镜载玻片上的透明液滴中进行。
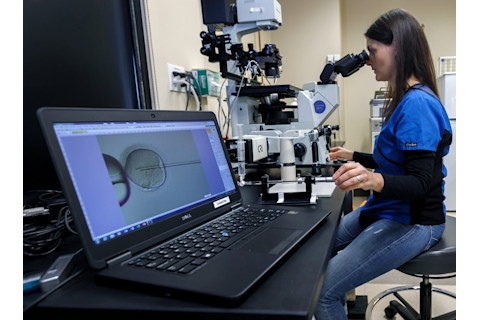
马蒂-古铁雷斯通过显微镜进行操作,而电脑屏幕显示着一个正在被针刺穿的人类卵子,针将注入精子和一定剂量的CRISPR-Cas9。 (图片来源:Kristyna Wentz-Graff/OHSU)
Kristyna Wentz-Graff/OHSU
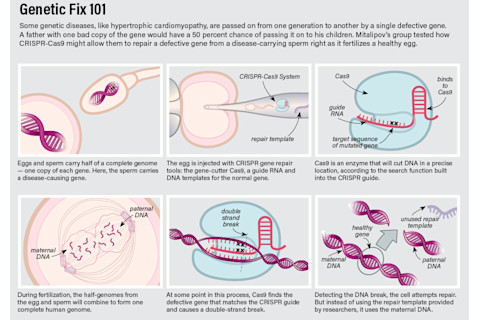
屏幕外,精子真空管短暂地停下来吸取一种额外的溶液,然后再次出现,准备就绪。片刻之后,卵子将不仅被注入精子,还将注入一定剂量的CRISPR-Cas9,这是一种DNA编辑系统,允许科学家切除一个基因片段并用另一个替换。如果一切顺利,CRISPR系统将使这个单细胞人类胚胎修复其DNA中导致疾病的突变。
俄勒冈健康与科学大学(OHSU)位于波特兰的这个实验室是美国唯一一个在人类胚胎中发表此类研究的团队。这些科学家正在研究人类基因编辑,希望治愈特定的遗传性疾病。自2017年他们宣称成功修复了带有致病突变的胚胎以来,他们一直面临着持怀疑态度的科学家和反对人类基因编辑人士的强烈反对。现在,随着一位中国研究员在2018年底宣布基因编辑双胞胎女孩出生,他们将在将技术推广到临床之前面临更多障碍。
双胞胎出生
在中国基因编辑婴儿出生这个消息公布时,也许没有人比OHSU胚胎细胞与基因治疗中心的舒克拉特·米塔利波夫(Shoukhrat Mitalipov)领导的团队更惊讶了。“我以为我知道所有在这方面工作的合法团队,”米塔利波夫说。
中国研究员贺建奎的声明去年11月发布,正值香港国际人类基因组编辑峰会前夕。他原计划在米塔利波夫的同事、妇产科副教授兼OHSU生育诊所医生宝拉·阿马托(Paula Amato)发言后不久,就其工作进行演讲。
“得知有人真的有胆量在安全性尚不明确的情况下转移这些胚胎并建立妊娠,我感到非常震惊,”阿马托说。米塔利波夫估计,这种基因编辑技术离进入临床试验——即在真实妊娠中的测试——还有五到十年。
除了科学挑战,法律和伦理考量通常也会减缓这类研究的进展。2017年,美国国家科学院和医学科学院召集了伦理专家和科学家,部分目的是决定是否以及如何允许对人类种系进行修改——即对将遗传给后代的DNA进行修改。该报告的准则旨在为人类基因编辑研究提供国际指导。
阅读更多:顶尖科学家呼吁暂停基因编辑人类婴儿的研究
但贺建奎的工作远远超出了这些准则,引发了全球科学界和伦理界的强烈反对。例如,国家科学院的报告明确指出,任何DNA编辑都应阻止严重的遗传性疾病。然而,贺建奎从一个健康基因开始,创造了一个被认为可以增加HIV抵抗力的突变。另一项标准是,编辑只能在“没有合理替代方案的情况下”进行。但HIV被认为是可预防和可治疗的。诸如此类的问题还有很多,关于其工作的合法性和透明度也备受质疑。
另一方面,米塔利波夫的团队正在致力于纠正一种名为MYBPC3的基因突变,这种突变会导致肥厚性心肌病(HCM)。这种心肌增厚会导致各种各样心脏问题。HCM最常成为新闻焦点,是因为它会突然夺走年轻运动员的生命,而尸检会发现先前未被诊断出的心脏病。目前没有治愈方法。
聚焦修复
贺建奎的一些最尖锐的批评者呼吁暂停类似的工作,但米塔利波夫希望这种反对不会干扰他团队的研究。
“暂停,”米塔利波夫说,“我讨厌这个词。”
团队工作的中断意味着放弃米塔利波夫多年来一直深切关注的问题。他回忆起,作为一名临床遗传学研究生,他学习如何根据患者的基因来诊断遗传性疾病。他对最终结果感到不满意。
“你会告诉病人,‘嘿,我们找到了,这是导致这种疾病的突变’,”他说,“然后病人会问,‘然后呢?’但就这样,我们的工作就完成了。”
于是他意识到,解决这些疾病——如囊性纤维化、镰状细胞贫血和亨廷顿病——的一种方法是在生命早期,在基因造成任何损伤之前,修复基因突变。非常早期:在胚胎时期。
但直到最近才有了明确的方法。

舒克拉特·米塔利波夫 (图片来源:Kristyna Wentz-Graff/OHSU)
Kristyna Wentz-Graff/OHSU
CRISPR(群集规整间隔短回文重复序列)最早的研究发生在大约30年前,但研究人员花了近所有的时间才弄清楚完整的CRISPR-Cas9系统并开始将其用于基因编辑。这种DNA序列系统天然存在于细菌中,帮助它们抵抗攻击性病毒。当细菌遇到特定病毒时,它们会整合一小段DNA,作为一种小纪念品,以便将来记住它们的病毒攻击者。细菌的防御系统包括一个搜索和摧毁功能,它使用病毒DNA作为搜索图像。该机制的一部分包括产生Cas9蛋白,该蛋白会剪切与模板匹配的DNA。对于试图侵入细菌细胞的病毒来说,这意味着游戏结束了。
如今,生物学家学会了重新编程CRISPR-Cas9,使其能够通过给它一个新的搜索目标来剪切细胞中的任何类型的DNA(不仅仅是病毒DNA),并定位到他们选择的位置。他们还发现,在DNA被Cas9剪切后,细胞会试图修复DNA的断裂。然后,这个修复系统可以被操纵,利用科学家提供的模板,有效地切除一个基因并用另一个基因替换它。
阅读更多:
米塔利波夫和志同道合的同事们相信CRISPR的潜力在于,他们将能够用一个功能正常的基因替换一个有缺陷的基因。为了验证这一点,OHSU团队发表在《自然》杂志上的实验很简单。他们使用携带缺陷MYBPC3基因的男性的精子和健康女性的卵子,看是否能利用CRISPR-Cas9来修复致病基因。
他们将每个卵子都注入了一个携带突变的精子和一个CRISPR-Cas9包装。在这个包装中,包括帮助Cas9找到致病基因的DNA搜索图像。他们还包含了一个与正常基因版本匹配的DNA序列,细胞将使用这个序列作为修复模板来修复其DNA中的断裂。他们在这个修复模板上加了一个小标记——交换了两个核苷酸碱基,这些碱基会改变正常基因的序列,但不会改变其功能。通过这种方法,他们可以知道细胞是否使用了他们的模板。
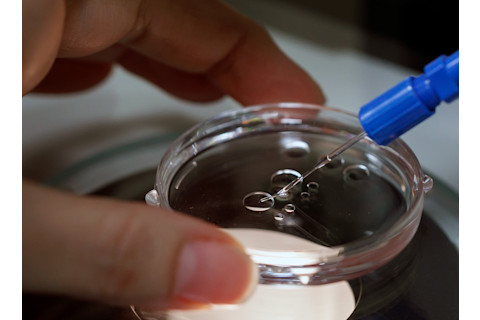
研究员努里亚·马蒂-古铁雷斯在俄勒冈健康与科学大学米塔利波夫实验室使用精密工具来操纵人类精子和卵子。(图片来源:Kristyna Wentz-Graff/OHSU)
Kristyna Wentz-Graff/OHSU
他们的实验奏效了,但结果并非如他们所料。Cas9确实定位并剪切了胚胎从父亲那里继承的致病基因。然而,胚胎并没有使用研究人员提供的模板,而是使用了母亲的正常基因作为模板,结果得到了两个正常基因。
然而,一些科学家仍然怀疑这些实验是否像米塔利波夫的团队声称的那样成功,因为很难确认基因编辑是否如计划进行。他们最大的阻碍是什么?一种可能性是,胚胎实际上并非拥有两个正常基因,而是拥有一个正常基因和一个缺失的基因,这被称为大片段缺失。这种现象在其他一些CRISPR研究中已有记载,这可能解释了为什么研究人员在检查编辑后的胚胎时没有检测到任何致病基因。如果批评者是对的,那么这些胚胎就远非健康。
保罗·托马斯(Paul Thomas),阿德莱德大学和南澳大利亚健康与医学研究所基因组编辑实验室负责人兼南澳大利亚基因组编辑设施主任,试图直接回答大片段缺失的问题。他的团队在小鼠胚胎中测试了米塔利波夫的方法,发现这些疑似的大片段缺失很常见。
作为回应,米塔利波夫的团队进行了一项后续实验,以证明他们的胚胎没有出现大片段缺失。但批评者,包括哥伦比亚大学细胞生物学家迪特·埃格利(Dieter Egli),并不完全满意。“Proposed repair mechanism的明确证据仍然缺失,”他说。
托马斯也表达了类似的看法。“两次研究之间出现这种差异的原因尚不清楚,”他说,“如果米塔利波夫团队的结果能在独立实验室使用人类胚胎的研究中得到复制,那将很有趣。”
法律障碍
抛开科学不谈,人类胚胎研究在后勤上是一个棘手的业务。在美国,生物医学研究的主要资金来源——美国国立卫生研究院(NIH)——不为这项工作提供资金。
OHSU团队通过私人资助解决了这个问题,但当他们准备将基因修复疗法——这是他们对移除疾病的胚胎编辑的称呼——推向临床试验时,将面临一个巨大的障碍。为此,团队需要获得FDA的批准。然而,在2015年,国会取消了FDA审查“有意创建或修改人类胚胎以包含可遗传基因修改的研究”的资金。
(图片来源:杰伊·史密斯)
杰伊·史密斯
这并没有阻止米塔利波夫推进他的工作;只是不允许他在美国寻求官方批准。因此,米塔利波夫表示,当胚胎基因修复准备好进行临床试验时,他会将其带到一个允许进行但同时拥有严格法律和伦理监管的国家,例如英国。
他认为,不继续研究和测试实验室中的胚胎修复技术实际上是不负责任的。这是因为一旦研究发表,思想就已经传播出去,每项研究的方法部分都包含了操作说明。他担心其他国家监管不同的研究人员或临床医生会在这些技术得到适当审查之前就加以利用。
“当然,我们会负责任地进行(海外临床试验),并得到适当的监管,”米塔利波夫说,“我们别无选择——我们必须这样做。我们已经开始了,我们不能把这项工作留给(体外受精)诊所去做。”
当父母希望避免将遗传疾病遗传给孩子时,阿马托说,一个可行的选择是进行体外受精(IVF),并使用所谓的胚胎植入前遗传学诊断(PGD)。在PGD过程中,医生会检查体外受精的每个胚胎,并丢弃携带疾病的胚胎。
如果基因修复可以取代PGD,那么这个过程就不需要进行,这可能会缩短紧张的IVF治疗。尽管在这项研究过程中会创建并随后丢弃人类胚胎,但该团队希望从长远来看,会销毁更少的胚胎。
未来展望
米塔利波夫认为,我们可能要十多年才能看到一个合法的基因修复人类婴儿,尽管贺建奎已经表明,有人可能会推进这项技术,无论是否经过科学审查和适当监管。
阿马托说,这是否是滑向“设计婴儿”的滑坡?不尽然。她说,目前,科学家甚至不知道诸如智力或运动能力等理想特征背后的复杂遗传基础。“这在技术上是不可行的,”她说,“但有些人会说这是敷衍。也许有一天我们会了解这些基因。”
“我认为(设计婴儿)还很遥远,”阿马托说——但并非遥远到研究人员不应开始考虑现在就监管可能创造它们的这项技术。“我绝对认为(这是)我们应该思考和注意的事情。”
安娜·芬克(Anna Funk)是Discover的助理编辑。在Twitter上关注她:@DrAnnaFunk。本文最初发表于印刷版,题为“修复未来”。

本故事是“生育的未来”(The Future of Fertility)系列的一部分,该系列是Discover刊登的关于生育前沿的新系列。
阅读更多