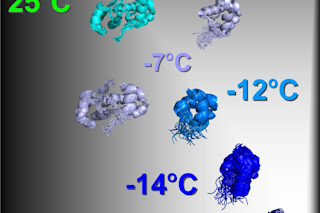
粪肠球菌 CylR2 蛋白质展开的“快照”。如果蛋白质从 25°C 冷却到 -16°C,它会依次分解成两个相同的亚基。后者最初是稳定的,但在 -16°C 时它们形成一种不稳定的、动态的蛋白质形式,这在折叠中起着关键作用。© Zweckstetter, 马克斯·普朗克生物物理化学研究所和德国神经退行性疾病中心 蛋白质——活细胞的工具——如果形状不对,就无法发挥作用。字面上看就是如此。一项新研究首次对蛋白质解体的各个阶段进行了成像,这将为阿尔茨海默病和帕金森病等疾病的治疗提供宝贵的见解。这些只是由错误折叠的蛋白质引起的疾病中的两种——它们的氨基酸链排列不正确,导致三维结构畸形。当错误折叠时,这些蛋白质无法工作,在阿尔茨海默病等疾病中,它们会堵塞大脑并最终破坏神经细胞。了解蛋白质如何折叠对于开发预防和治疗这些疾病的方法至关重要。以前记录该过程的尝试涉及加热或化学物质,创造了蛋白质迅速解体的条件,从而限制了对中间状态的观察。然而,现在,通过使用低于冰点的温度和核磁共振(NMR)光谱学,蛋白质展开的行为被减慢到足以首次以原子分辨率可视化。一个由德国和波兰科学家组成的团队“拍摄”了 CylR2 蛋白质的展开过程,选择它是因为它由两个相同的亚基组成,团队认为这将使其更容易可视化。但忘了好莱坞吧:这种蛋白质是在实验室而不是制片厂首次亮相的,化学家们将蛋白质从 77 华氏度冷却到 3 华氏度(25 摄氏度到 -16 摄氏度),使用核磁共振光谱法捕获其在七个中间阶段的外观。该团队能够确定展开过程中蛋白质亚基失去稳定性的点:根据结构生物学家 Markus Zweckstetter 的说法,这是蛋白质最初产生时可能发生错误折叠的“触发点”。Zweckstetter 和他的同事们将他们的发现发表在《自然化学生物学》杂志上,他们相信他们的发现将提供一种新的方法来研究蛋白质如何形成其三维形状以及为什么它们有时会错误折叠,从而回答理解疾病的一个重大问题。
广告