在20世纪80年代末,马克斯·普朗克精神病学研究所的研究人员为了测试慢性疼痛治疗方法,向一只实验鼠的右后爪注射了弗罗因德完全佐剂,这是一种能引发炎症的化合物。他们施用的第一批止痛药之一是吗啡。
当他们探查其爪子是否有触痛时,发现吗啡如预期的那样麻痹了组织。
但科学家们也注意到了一些奇怪的现象。另一只未事先发炎的后爪,仍然对触摸敏感。由于吗啡遍布该啮齿动物的血管,那只脚也应该麻木。根据教科书的说法,吗啡在中枢神经系统中发挥止痛作用。因此,注射应该使老鼠全身同等地脱敏。
普朗克研究所的实验表明,该药物是局部作用的。发炎爪子中的神经细胞或神经元对吗啡产生了反应,而某种关于炎症的因素赋予了止痛药的效力。
克里斯托夫·斯坦(Christoph Stein)领导了这项研究,他说:“起初,我们没有解释。”
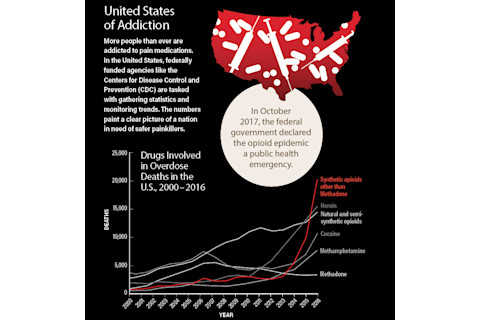
斯坦实验中的困惑结果为止痛药研究开辟了新途径,而这一领域在未来几年将受到更多审视。到21世纪初,阿片类药物依赖已成为全国性的流行病。如今,有21%至29%的慢性疼痛患者被处方阿片类药物,但他们滥用了这些药物。更令人烦恼的是,作为街头毒品销售的非法形式的处方阿片类药物可能比海洛因强50到5000倍。2015年,200万美国人患有处方阿片类药物成瘾,超过33,000人死于阿片类药物过量。2016年,死亡人数上升至42,000多人。2017年10月,联邦政府宣布阿片类药物流行病为公共卫生紧急事件。
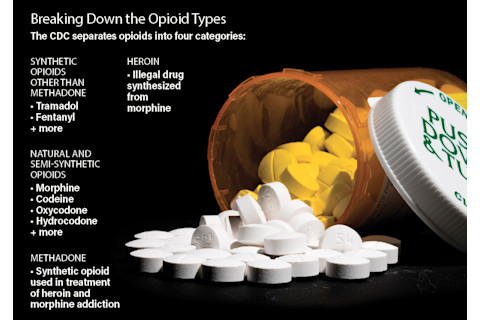
尽管早在几个世纪前就有滥用吗啡等早期阿片类药物的历史,但今天的危机根源始于20世纪90年代,当时医疗行业将疼痛管理作为优先事项,制药公司将其产品宣传为无成瘾性。医生开始开具强效的新型阿片类药物,有时甚至是为了缓解轻微的不适。结果,化学上受鸦片罂粟启发而来的药物变得像创可贴一样普及。
TeddyandMia/Shutterstock; Alison Mackey/Discover
起初,许多患者的生活质量得到了改善。但随着使用者对阿片类药物的耐受性增加,医疗保健专业人员开出越来越大的剂量来维持药物的止痛效果。而更大的剂量则放大了不良副作用的危险。特别是,阿片类药物通过与体内其他重要生物功能相关的机制来阻断疼痛。稍微改动一个,其他功能就可能失衡。
“疼痛处理……是一个已经进化了数亿年的相当复杂的系统,” Edward Bilsky说,他是太平洋西北健康科学大学的阿片类药物药理学家和教务长。“大脑和脊髓中有许多阿片类受体。”
其中一些受体在身体受伤时会抑制神经元发出的信号。另一些则激活多巴胺的释放,导致欣快感以及对更多多巴胺的渴望。还有一些则调节呼吸。在阿片类药物过量时,呼吸系统对血液中二氧化碳水平升高的反应会减弱。“人们会失去意识,” Bilsky说。“几分钟之内,他们就死了。”
然而,阿片类药物在现代医学中仍然至关重要。“在临床上,阿片类药物仍然是缓解疼痛的最佳方式之一,” UT健康圣安东尼奥牙科学院副教授Nathaniel Jeske说。“它们不会很快消失。”
包括Jeske、Bilsky和Stein在内的创新型阿片类药物研究人员认识到阿片类药物的医学必要性以及解决严重副作用的必要性。尽管他们的方法不同,但他们都旨在生化控制成瘾周期:制造能缓解疼痛但又不致死的阿片类药物。
Phil Lowe/Shutterstock
酸性环境
斯坦在80年代末意外发现止痛和炎症之间的联系,开辟了新的疼痛治疗途径。阿片类药物通过与神经元表面的特殊受体结合来阻断疼痛。这些受体就像开关。当阿片类分子嵌入其中时,它们会关闭疼痛信号。
科学家们已经熟悉了这种机制,并发现阿片类受体分布在大脑和中枢神经系统中。但当斯坦表明吗啡在实验鼠发炎的后爪上局部作用时,他首次证明了全身的神经元表面(从头到脚)都分布着阿片类受体。
他的研究表明,这些外周受体很特别。与大脑中始终对阿片类药物敏感的受体不同,炎症的特殊之处在于它使外周受体对止痛药产生反应。由于发炎组织比未发炎组织酸性更高,他推测受体的分子结构会因酸性而改变。他认为pH值的变化可以帮助阿片类药物和受体结合。
斯坦认为他可以制造一类新的合成阿片类药物,能够直接作用于疼痛部位,而不影响其他任何地方。但为了设计药物,他需要看到受体结构如何因pH值变化而改变。
斯坦与数学家合作,并基于早期创建阿片类受体三维可视化的研究,构建了一个可以重现与炎症相关的酸性的计算机模型。“我们在不同的pH条件下运行了模拟,”他说。他发现酸性不仅改变了受体,还改变了阿片类分子。这两种变化都是在体内激活受体所必需的。
斯坦基于这一观察的宏大设想是创造一种完全在大脑外起作用的新型阿片类药物。它只会在高于大脑正常pH水平的高酸性条件下激活,因此永远不会与大脑的受体结合。通过改变芬太尼(一种流行的合成阿片类药物)的一个原子,他制造了一种高度靶向的化合物,称为NFEPP。
斯坦目前是柏林夏里特医院和自由大学麻醉学系的系主任,他已经用弗罗因德完全佐剂引起的炎症实验鼠测试了NFEPP,初步结果令人鼓舞。“当我们将新化合物的镇痛效果与普通芬太尼进行比较时,我们发现效力非常相似,”他说。而且他没有检测到芬太尼的任何不良副作用,包括呼吸抑制、便秘和与成瘾相关的欣快感:“它几乎100%在大脑外起作用。”
然而,尽管斯坦正在改进NFEPP以进行人体试验——这个过程将耗资约600万美元,耗时数年——但他并不声称它能单独治愈阿片类药物流行病。他和研究人员指出,某些类型的疼痛,如烧伤后的慢性疼痛,不涉及炎症。使药物更安全的确切机制可能使其对某些需要止痛的人无效。
消除渴望
Bilsky在20世纪80年代末开始给啮齿动物用药。在他职业生涯早期,他曾研究过可卡因和MDMA。在连续几天给实验鼠注射其中一种药物后,他使用了一种称为条件性地点偏好(conditioned place preference)的测试,以了解它们是否会产生对药物的喜好:他观察了实验鼠是否会偏爱它们经常获得药物的笼子区域,即使没有药物出现。不出所料,这些啮齿动物在那里徘徊。
但当Bilsky给实验鼠注射可卡因或MDMA和一种叫做CGS 10746B的化学物质时,效果完全不同。CGS 10746B抑制大脑中多巴胺的释放。没有多巴胺的暴露,实验鼠从未产生渴望。
根据Bilsky的说法,当你考虑到多巴胺的工作方式以及身体最初为什么使用它时,这些结果是有道理的。多巴胺是一种神经递质——一种促进神经元之间交流的化学物质——其目的之一是强化行为。“这是非常原始的,”他说。例如,当动物找到一个好的食物来源时,多巴胺的释放有助于生物体学习并记住要回来获取更多。多巴胺是一种天然奖励。
“但当你服用滥用药物时,那是一种更强的刺激,”他说。大脑在可卡因影响下释放的多巴胺仍然会影响学习和记忆,“但在这种情况下,它是病态的。它是如此强烈,以至于我们开始淹没所有那些自然奖励。”
由于阿片类药物以与可卡因类似的方式劫持了天然奖励系统,瓦伦西亚大学的研究人员在21世纪初测试了CGS 10746B对吗啡的效果。他们的结果与Bilsky的相符,但两个团队都面临着同样的问题。多巴胺对于包括运动系统控制在内的其他功能至关重要。各种多巴胺受体管理着这些功能,因此Bilsky和他的同事们必须识别出最有潜力靶向的特定多巴胺受体亚型。在减少副作用方面,最 promising 的一种受体是D3受体。
D3受体最密集地集中在大脑的学习和记忆中心。像所有受体一样,它们可以被某些叫做激动剂(agonists)的化学物质激活。其他化学物质,称为拮抗剂(antagonists),通过阻止激动剂进入来关闭受体。Bilsky的想法是识别一种D3拮抗剂,它可以在不影响其他多巴胺通路的情况下阻断D3受体。他发现一种称为SR 21502的拮抗剂可以做到这一点。为了测试将其与阿片类药物结合的效果,Bilsky和同事们一直在给小鼠服用SR 21502,并观察它们在注射诱导吗啡戒断的化学物质后的行为。通常,这种药物会使小鼠非常焦躁——字面意义上的。小鼠会上下跳跃。初步结果表明,SR 21502能够中和该症状以及其他症状,包括腹泻。
然而,也有权衡。虽然SR 21502似乎不影响运动协调,但它似乎确实会减弱吗啡的止痛效果。需要更高的剂量,这可能不适合给药,或者可能引起其他副作用。Bilsky希望使拮抗剂更有效、更易于使用。与此同时,其他实验室正在尝试使用不同的化学物质来完全或部分阻断D3受体。“药物开发是一个漫长而缓慢的过程,” Bilsky说。“你必须确保它在临床人群中既安全又有效。”
德尔塔部队
如今市场上大多数阿片类药物只与一种受体相互作用。它被指定为希腊字母mu (μ),负责吗啡和芬太尼的镇痛作用和副作用。但mu并非唯一的阿片类受体。研究人员已发现另外两种:kappa (κ) 和 delta (δ)。尽管它们在被不加区分地激活时会导致从癫痫发作到情绪改变的各种反应,但这些受体可能提供管理疼痛的替代途径。
Bilsky特别关注delta受体及其激活它们的阿片类药物,因为它们不像mu激动剂那样作用于大脑的多巴胺系统。至少在实验鼠中,它们似乎不会引起强烈的欣快感,因此在人类中可能不太容易上瘾。(作为一项额外的好处,它们也不太可能抑制呼吸。)尽管研究人员仍然不知道这些激动剂在减轻人类疼痛方面有多有效,但Bilsky已经致力于开发靶向大脑delta受体的化合物。
Jeske同意Bilsky关于delta激动剂更安全的观点,但像斯坦一样,他也专注于靶向外周阿片类受体。与斯坦——其策略是在炎症期间靶向mu受体——不同,Jeske希望阿片类药物即使在非酸性条件下也能缓解烧伤引起的慢性疼痛。“这是一个未被发掘的需求,”他说。
在过去的几年里,Jeske一直在研究实验鼠的delta阿片类受体。通过观察正常和炎症条件下的受体,他发现了一种叫做GRK2的蛋白质,它充当阿片类受体的守门员。他解释说,当炎症超过某个阈值时,会发生一系列化学反应,最终将GRK2移走,有效地打开大门,让阿片类药物激活受体。
Jeske现在正在寻找能与受体接触时就分离GRK2的化学物质。他希望将这些与delta阿片类药物结合,以他所描述的“双管齐下”的方式,同时移走GRK2守门员并向受体输送止痛剂。
Kappa受体最近也成为了有前景的镇痛靶点。1月份,由北卡罗来纳大学教堂山分校药理学家Bryan Roth领导的一个团队宣布,他们成功地成像了kappa受体在被阿片类药物激活时的结构。鉴于受体在激活过程中并非静止不动,这极难实现。清晰的图像使研究人员能够看到各个部分如何相互作用。希望是,了解受体如何吸收激动剂将使其能够改变激动剂以更好地靶向特定受体类型。
Roth利用图像设计了一种选择性地、强烈地结合kappa受体的激动剂。他已经通过在实验室的细胞培养物上测试该药物来验证了计算机模拟。通过仅激活kappa受体,该化学物质不应引起与mu相关的任何副作用。下一个挑战将是减轻kappa系统本身的副作用,这些副作用可能包括幻觉和烦躁不安。Roth认为,通过精确控制药物与受体相互作用的位置和方式,这可能是可能的。他激活的kappa模型可以指导发现过程。
Roth和其他研究人员的开创性工作代表了受危机启发的创新新水平。“我们所做的就是努力找到一种更好的阿片类药物使用方式,这种方式不会产生导致阿片类药物流行的负面副作用,” Jeske说。与此同时,他们的工作反映了人们对制药行业局限性的日益认识。
“我们一直在寻找这些广谱药物,这些重磅炸弹,” Bilsky说。“我们必须调整思路,以便能够针对可能从这些细微疗法中受益的较小群体。”
结束阿片类药物流行病需要的不仅仅是巧妙的化学。我们还需要治愈我们对简单解决方案的“成瘾”。
研究人员和卫生专家正在深入分析数据,以帮助找到解决国家阿片类药物流行病的办法。对1996年至2012年数据的最近一项审查发现,急诊室的止痛药处方有所下降,而医生办公室的处方却显著增加。这些信息可以帮助政策制定者确定努力的方向。