十多年来,位于马萨诸塞州北安多弗的奇弗斯家那栋谷仓式住宅里,第一次充满了惊人的寂静。曾经每晚困扰着14岁的劳拉和12岁的凯特姐妹俩、让她们精疲力竭、虚弱不堪的深沉、隆隆的咳嗽声,终于停止了。
她们的身体几乎摆脱了危及生命的肺部感染——这种感染需要住院治疗和使用损害器官的强效静脉注射抗生素,并夺走了许多患有囊性纤维化儿童的生命。现在,曾经用于对抗疾病的卡路里,为她们娇小的身躯增加了体重,并给予她们踢足球和跳舞的能量。“而且,”劳拉和凯特的父亲罗布·奇弗斯说,“她们尝起来不再咸了。”
“是的,我尝起来像个普通人,”凯特俏皮地说道,她指的是咸汗,这是该疾病的一个标志性特征。
劳拉和凯特是成千上万患有囊性纤维化(CF)的美国人中的一员。这是一种遗传性疾病,会使浓稠的粘液堵塞肺部,引发最终致命的慢性感染。在美国,每3900名新生儿中就有一人受此影响,囊性纤维化是已知的最常见的遗传性疾病之一。然而,受其困扰的人数太少——在美国仅有3万人,全球估计有7万人——以至于制药行业难以收回开发该疾病药物的巨大成本。
对劳拉和凯特来说,前景已经改变。她们是2000年一次赌博的受益者,当时,运营囊性纤维化基金会(CFF)的家长和志愿者们向一家初创生物技术公司提供了超过4000万美元,以寻找治愈方法。
在此之前,这个成立于1955年的倡导组织,其运作方式与其他此类组织大同小异。面对一种如果不经治疗就会在5岁前夺走许多孩子生命的疾病,CFF成员们建立了患者登记系统,并在全国范围内设立了治疗中心。他们定期举办筹款活动,以开发新药,例如分解粘液的药物,或能深入肺部对抗感染的雾化抗生素。通过缓慢而稳步的进展,他们将孩子们的寿命延长了十年或更久。
然后在13年前,该组织进行了一次战略性的豪赌,决定资助寻找一种治愈方法,这种方法不针对囊性纤维化的症状,而是针对导致该疾病的缺陷蛋白质。在绝望父母的敦促下,董事会扩展了传统的非营利模式,成立了独立的囊性纤维化基金会治疗公司(Cystic Fibrosis Foundation Therapeutics Inc.),以引领药物发现。
它用基金会筹集的资金聘请公司开发药物,然后帮助他们在临床试验中测试这些药物。作为回报,该治疗公司通过共同开发的药物获得特许权使用费,这些收入立即被投入到更多的药物发现中。
在此过程中,基金会带来了一种生物技术或制药公司单打独斗时无法企及的紧迫感和专注度。“我们就像一匹戴着眼罩的赛马。目标是为患者提供药物。我们所做的一切,都通过这个视角来审视,”微生物学家埃里克·奥尔森说,他在位于马萨诸塞州的福泰制药公司(Vertex Pharmaceuticals)领导囊性纤维化的研究,该公司发现了凯特和劳拉所用的药物。
与基金会的合作让福泰公司始终保持目标明确,因为每个人都与结果有个人利害关系。“没有什么比这更强大的了,当这是你自己的孩子、你的兄弟、你的姐妹时,它会让你专注于实现真正的东西,即使这需要20年。”
福泰公司的第一款囊性纤维化药物,名为Kalydeco,是患者力量的惊人证明。在2010年参与一项临床试验时,劳拉和凯特服用了一种药物,该药物进入她们的细胞并修复了导致她们生病的缺陷蛋白质。随着蛋白质功能几乎恢复到健康人的水平,女孩们重获了她们的生活。
劳拉和凯特患有一种特别罕见的突变——在美国仅占囊性纤维化病例的4%。但这种变革性药物的成功,预示着囊性纤维化社区的其他成员也将迎来类似的治疗方法。福泰公司已经为患有最常见囊性纤维化突变(导致绝大多数病例)的患者开发了一种药物鸡尾酒疗法,目前III期临床试验正在进行中。
追踪囊性纤维化基因
在20世纪70年代,当弗朗西斯·柯林斯(现任美国国立卫生研究院院长)对囊性纤维化产生兴趣时,人们对该病的病因知之甚少。1978年,柯林斯在北卡罗来纳州教堂山的北卡罗来纳纪念医院担任内科住院医师,当时他被指派照顾一名刚被诊断出患有囊性纤维化的19岁护士。这个病例很不寻常,因为该病通常在儿童时期诊断,但她显然符合标准:她的肺部正被浓稠、粘稠的粘液破坏,这些粘液成为致病细菌感染的温床,而且她的汗液很咸,这是柯林斯当时还不理解的囊性纤维化病理生理学的一个功能。
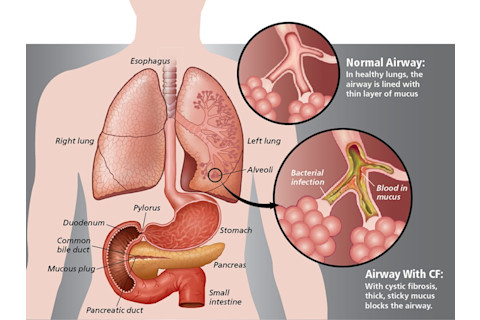
囊性纤维化是一种慢性疾病,影响美国约3万名儿童和成年人(全球约7万人)的肺部和消化系统。一个缺陷基因及其蛋白质产物导致身体产生异常浓稠、粘稠的粘液,堵塞肺部并导致危及生命的肺部感染。这些粘液还会阻塞胰腺,阻止天然酶帮助身体分解和吸收食物。(图片来源:Jay Smith/Discover)
Jay Smith/Discover
“很明显,我们知之甚少,”他今天说道。囊性纤维化是多变的。在病情谱的一端,浓稠的粘液扰乱了身体的功能:它阻碍胰腺输送食物消化和吸收所需的酶,导致营养不良,并引发严重的肺部感染,通常在5岁前导致儿童死亡。而在另一端,则是一种较温和的疾病,感染罕见,营养问题少,寿命正常。
囊性纤维化被认为是一种遗传性疾病,以隐性遗传方式遗传。这意味着你需要两个坏的基因拷贝——父母各一个——才会得病。突变的基因会产生有缺陷的蛋白质,这些蛋白质无法在细胞内执行其功能,导致细胞功能失常,并最终引发疾病。
只有一个突变拷贝的父母是健康的,并且通常不知道自己携带了一个缺陷基因。尽管像柯林斯这样的科学家知道遗传模式,但没有人知道这个基因是什么,或者它究竟产生了哪种蛋白质。就柯林斯而言,当时没有明显的方法可以找出答案。
这种情况在20世纪80年代初发生了改变,当时科学家们发现了亨廷顿舞蹈病的独特DNA模式或遗传标记,这是一种致残的神经退行性疾病。这一发现“激发了每个人的想象力,”柯林斯说。
受此成就的鼓舞,柯林斯即将合作的伙伴,来自香港的分子生物学家徐立之,在多伦多病童医院的一个囊性纤维化实验室开始寻找这个缺陷基因。徐立之读到过一种技术,可以通过存在于病人但健康人中没有的DNA标记来定位目标基因。通过与他所在医院的医生和护士密切合作,他很快就从多伦多约20个囊性纤维化家庭获得了血液样本,后来又从加拿大各地30多个这样的家庭获得了样本。
到1985年,柯林斯在安娜堡的密歇根大学拥有了自己的实验室,他也在做同样的事情。虽然当时还没有人对完整的人类基因组进行测序,但研究人员对基因如何出错已经有了一些了解。
他们知道人类基因组被划分成23对结构,称为染色体,由脱氧核糖核酸(DNA)构成。DNA的字母表只有四个字母,A、C、G和T,分别代表四种化学单位或碱基:腺嘌呤、胞嘧啶、鸟嘌呤和胸腺嘧啶。这些碱基配对,腺嘌呤与胸腺嘧啶结合,胞嘧啶与鸟嘌呤结合。人类基因组在其23对染色体上有30亿个这样的碱基对,但即使是删除或改变一个A、C、G或T,也可能导致疾病或死亡。
“当你想寻找一些细微的东西时,基因组是一个非常巨大的地方,”柯林斯指出。尽管如此,寻找囊性纤维化家庭,特别是他们患病孩子独有的DNA模式的竞赛已经开始。1985年,徐立之使用DNA标记将囊性纤维化基因定位到了7号染色体。
一个团队,包括来自盐湖城犹他大学和伦敦圣玛丽医院医学院的成员,通过找到基因两侧的一些DNA路标,进一步缩小了区域,无论这个基因是缺陷的还是正常的。这些标记就像高速公路上的路标;基因就像介于两者之间的酒店。
但这些标记之间的遗传距离是巨大的——大约150万个DNA字母的长度。在1985年,在两个标记之间寻找基因的标准方法是逐个字母地筛选DNA,这种技术被称为染色体步移。然后,柯林斯开发了一种他急于测试的更快方法:染色体跳跃,这使他能够一次跨越数万个字母的遗传区域。
“这个想法是,如果你知道它在这两个标记之间,你就可以从两端开始向中间跳跃,这样你会比必须一步一步走要快得多,”他解释道。
为了进一步加快速度,柯林斯和徐立之在1987年联手,动员了大约20名科学家组成的小分队,寻找那个在患者汗腺、胰腺和肺部——所有受该病影响的器官——中肆虐的可疑基因。发现的时刻发生在1989年6月一个下雨的夜晚,在耶鲁大学,当时柯林斯和徐立之正在参加一个关于绘制人类基因组的战略会议。
会议期间,两人住在学生宿舍里,由于远离他们的实验室而感到不安,当时对大量囊性纤维化患者DNA的关键分析正在进行中。一天晚上大约10点,他们躲在徐立之的房间里,疲惫地翻阅着从一台小型传真机(80年代的高科技数据传输方式)传来的遗传数据,这台传真机连接着徐立之的实验室。
当他们筛选数据时,7号染色体上一个令人不安的模式变得清晰:大多数囊性纤维化患者都缺失了一小段DNA,一个由三个字母CTT指定的碱基序列。这是基础生物学。在健康受试者中,代码是完整的。健康的基因产生一个含有1480个氨基酸单位的蛋白质。
受损的版本产生了一个较短的、有缺陷的蛋白质,只有1479个氨基酸;它缺少一个名为苯丙氨酸的重要氨基酸。这个微小的变化足以导致这种残酷、致命的疾病。“对我来说,那就是那个时刻,”柯林斯承认道。“我想跳起来尖叫。”
破损的细胞
找到这个突变是迈向治愈的第一步,但柯林斯和徐立之仍然需要弄清楚这个基因的作用,以及7号染色体上的突变是如何使其偏离轨道的。他们推测,无论该基因编码何种蛋白质,最终都会导致身体的水盐平衡失调。细胞中过多的盐会导致它们从周围的粘液中吸水,使粘液变得粘稠,从而导致感染。过多的盐也解释了咸汗的现象——这些都是囊性纤维化的典型特征。
为了解释盐失衡,一个可能性脱颖而出:阻断氯离子——食盐分子氯化钠的一半——进出细胞。一个突变的基因产生一个参与氯离子流动的破损蛋白质,可能会导致盐失衡以及所有观察到的破坏性后果。
为了跟进这一想法,柯林斯和徐立之招募了生物化学家杰克·里奥丹,他与徐立之一起工作。里奥丹是ABC转运蛋白方面的专家,这种蛋白质是分子电梯,负责在细胞膜内外穿梭脂肪、药物和其他分子。里奥丹分析了囊性纤维化患者咸汗腺中的细胞,证明突变基因是活跃的,并产生了一个有缺陷的蛋白质。然后,他使用计算机将构成该蛋白质的氨基酸串与所有其他已知蛋白质的氨基酸序列进行比较。
当他注意到与他的ABC转运蛋白有相似之处时,他惊呆了:囊性纤维化蛋白质有亲水的部分,也有疏水的部分。并且,就像那些转运蛋白一样,这种蛋白质呈管状,嵌在细胞的外表面,类似于一种可以移动氯离子进出的生物阀门。这与徐立之-柯林斯的假设完全吻合:一个功能失常的氯离子通道显然导致了囊性纤维化。
1989年8月22日,徐立之和柯林斯发现导致囊性纤维化基因的消息泄露给了媒体。两天后,这两位年仅38岁和39岁的研究人员被匆忙带到华盛顿特区,参加了一系列新闻发布会,这比预定在《科学》杂志上背靠背发表三篇论文的时间早了将近两周。这些论文描述了新命名的囊性纤维化跨膜调节因子(CFTR)基因的位置、其特定的遗传密码以及其产生的蛋白质的拟议结构和功能。
基因疗法的失败
有了囊性纤维化基因,基于基因疗法的治愈方法似乎触手可及。尽管该病影响多个器官,但致命的是肺部感染。因此,柯林斯和徐立之推断,如果能将健康的基因送入肺部,他们就能治愈该病最严重的破坏。
柯林斯一直与一位主要的人类基因疗法倡导者詹姆斯·威尔逊定期通信,威尔逊很快就将他的实验室搬到了密歇根大学,就在柯林斯的隔壁。到1990年,柯林斯和威尔逊正在用健康的CFTR基因改造一种实验室制造的病毒,然后像特洛伊木马一样将其送入,以感染从囊性纤维化患者身上取出并在实验室培养皿中维持生命的细胞。
患病的细胞欢迎健康的CFTR基因,并用它来制造功能正常的通道,允许氯离子进出细胞。这是一个惊人的证明,表明健康的基因可以胜过受损的基因并修复细胞,至少在培养皿中是这样。到1993年,在对狒狒的试验中,威尔逊证明该病毒可以将健康的CFTR基因导入肺细胞。
但将这项技术应用于人类却极具挑战性。同年,在囊性纤维化患者中植入健康CFTR基因的努力遇到了障碍,因为病毒引发了令人担忧的炎症和发烧,导致研究人员重新设计病毒并重新思考他们的策略。
研究人员一直尝试到1999年12月,当时威尔逊公布了对11名囊性纤维化志愿者的I期试验结果,结果显示,在没有免疫排斥的情况下,将基因永久有效地导入肺细胞几乎是不可能的。“我们花了好几年的时间碰壁,才意识到这有多难,”柯林斯说。没有人预料到免疫系统会对病毒做出如此强烈的反应,并“基本上注定了我们方法的失败”。
开辟另一条道路
在发现导致该病的CFTR基因后的几年里,柯林斯、徐立之等人发现情况比他们想象的要复杂得多:研究人员发现该基因中并非只有单一突变,而是有大约1900种不同的突变。其中大多数会导致疾病,它们之间的差异解释了医生所见的严重程度不同的情况。
最常见的突变是柯林斯和徐立之在1989年发现的。他们将其命名为Delta F508,代表在CFTR蛋白质第508位缺失的氨基酸苯丙氨酸。带有这种突变的CFTR蛋白质无法正确折叠,也无法到达它通常所在的细胞表面,从而为氯离子提供进出的通道。相反,有缺陷的蛋白质仍然卡在细胞内部,就像一个困在气球里的麦圈。
柯林斯意识到,修复这一个突变,大约4%的白种人携带此突变,可以帮助近90%的囊性纤维化患者。但他的实验室在1994年迁至马里兰州贝塞斯达的美国国家人类基因组研究所后停止了相关工作,以领导一项大规模的政府人类基因组测序项目,该项目最终将绘制出整个人类遗传密码。
同年,罗伯特·比尔,一位前生物化学家,于1980年离开美国国立卫生研究院,到非营利性的囊性纤维化基金会工作,并成为其首席执行官。在80年代,那是一个草根组织。家长们带来食物,操作投影仪,并招待少数出席的科学家。“他们没有太多科学,”比尔说,“但我爱上了那些人和那些正在寻找希望的家长们。”
比尔经历了囊性纤维化基因发现的情感过山车,和别人一样,他也期待新疗法的出现。他解释说,当大家在90年代初都沉浸在基因疗法热潮中时,“我们也一样。”
但随着囊性纤维化基因疗法的努力接连失败,比尔知道他必须找到另一条路。“我们发现了囊性纤维化基因,知道了疾病的根本原因,”他说,“但制药公司仍然没有参与进来。”
比尔告诉家长们是时候开辟另一条道路了。他在查阅科学文献时,偶然发现一篇描述高通量筛选的文章,这是一种新技术,使用机器人每天在实验室培养皿的细胞中测试数千种化合物的治疗特性。反思目前的僵局,比尔认为这可以为囊性纤维化提供一个答案:与其给患者健康的CFTR基因,他将发起一场大规模的化学物质搜索,以修复患者细胞中的突变蛋白质。
没有庞大的政府资助,比尔知道没有任何学术团队能够承担这一挑战。也没有公司会 embark on 如此昂贵的药物搜索,因为对于这样一种罕见病,它永远无法收回投资。相反,CFF 需要带头,保护公司免受风险。
在当时,一个非营利组织进行这样的赌博是闻所未闻的。毕竟,比尔承认,他对药物发现知之甚少。“我们即将要做的是一件有风险的事情,”比尔当时告诉他的董事会。“我们将进行大笔投资。但对我们来说,最大的风险是不去做这件事。”
比尔手握320万美元的初始资金,联系了文章中提到的五家专注于高通量筛选的技术领导者;其中两家回复了他的电话。一家是奥罗拉生物科学公司,一家位于圣地亚哥的初创公司,专门从事药物候选物的筛选。他们一致认为,找到一种能够与缺陷蛋白质相互作用并纠正它的分子是可能的。
奥罗拉公司带来了一个金钱无法买到的优势:保罗·内古列斯库,一位细胞生理学家,他在伯克利读研究生时研究过囊性纤维化。内古列斯库很清楚,这项任务很复杂:近1900种导致CFTR蛋白质功能失常的突变,每一种都需要其独特的修复方法。
但从最常见的突变开始是合理的,即柯林斯和徐立之的Delta F508,这个突变困扰着大多数囊性纤维化人群。(在囊性纤维化患者中,约50%携带两个带有Delta F508突变的基因拷贝,另外40%携带一个拷贝;只有一个Delta F508拷贝的患者,还携带第二个坏的囊性纤维化基因拷贝,但带有另一种也必须修复的突变。)约10%的人患有不涉及Delta F508的罕见突变。
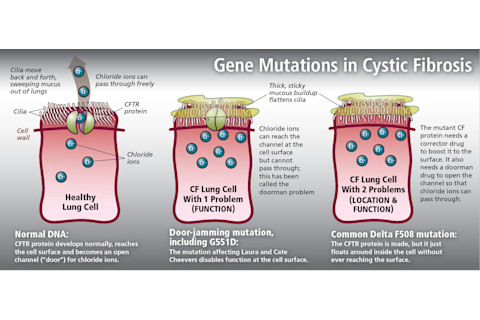
内古列斯库知道,带有Delta F508突变的患者产生的CFTR蛋白质无法正确折叠,就像一个揉皱的折纸雕塑,使其甚至无法到达细胞表面,而它本应在那里。要重新定位该蛋白质,需要一种药物——被称为“校正剂”——来调整其形状,以便它能被运输到细胞外表面。
但是,一旦这个有缺陷的蛋白质被固定在位,还有第二个问题:该蛋白质仍然不允许氯离子进出细胞。就好像一扇门被卡住了。要把它撬开,需要第二种“门卫”药物。
患有Delta F508突变的患者需要两种药物。但像劳拉和凯特这样患有更罕见突变(称为G551D)的患者可能更容易治疗。与常见的Delta F508突变不同,G551D突变产生的蛋白质能够到达细胞表面并嵌入膜中,但它遇到了门卡住的问题:氯离子仍然无法流入流出。奇弗斯姐妹只需要“门卫”来清除阻碍氯离子来回流动的障碍。
(图片来源:Jay Smith/Discover,资料来源:Vertex Pharmaceuticals)
Jay Smith/Discover,资料来源:Vertex Pharmaceuticals
寻找药物
为了加速药物发现,内古列斯库和奥罗拉团队同时寻找校正剂和门卫药物。为了从1997年开始执行他们的高通量搜索,他们在塑料托盘中培养携带功能失常的CFTR蛋白质的细胞,每个托盘包含384个微孔,呈16x24的网格状。
为了识别校正剂,将一种独特的候选药物添加到每个孔中,并在体温98.6华氏度下浸泡过夜。接下来,向混合物中添加一种荧光染料。然后他们加入一种名为染料木黄酮的化学物质,这是一种已知的开门药物,但不幸的是,它太弱了,只在试管中有效。最后,一个机器人眼扫描每个混合物。
如果细胞未受影响,染料会使它们发出橙色光。但如果突变的囊性纤维化蛋白质被校正剂候选药物提升到细胞表面,那么染料木黄酮作为门卫,会打开通道,允许氯离子进出,使细胞发出蓝色光。
为了寻找门卫药物,内古列斯库的团队采用了几乎相同的策略,但他们将细胞与候选药物在更低的80.6华氏度下孵育过夜。方便的是,这个较低的温度充当了校正剂,帮助更多带有Delta F508突变的蛋白质到达表面,在那里它们遇到了候选的门卫药物。如果化学物质没有影响,细胞会发出橙色光。如果分子能打开通道,细胞会发出蓝色光。
内古列斯库团队开发的检测方法奏效了。一些候选药物确实能将突变的CFTR提升到细胞表面,而另一些似乎能打开那扇门。这证明了这种新的自动化筛选系统能够发现一些变革性的东西。然而,在总共测试了122,000种化学物质后,研究人员发现,即使是那些早期显示出潜力的物质,在后来的试验中也失败了。有些有毒,有些太弱,还有一些,无论出于何种原因,都无法在第二次尝试中激活CF蛋白质。
奥罗拉公司的科学家们相信,只要筛选更多的分子,就能找到有效的。2001年,当福泰制药公司收购奥罗拉公司时,它决定继续这项探索,只要比尔能筹集到足够的资金来维持项目运转和梦想的延续。
家长的力量
就在那时,比尔招募了乔·奥唐奈,一位囊性纤维化患儿的父亲和筹款高手。乔和凯茜·奥唐奈是马萨诸塞州本地人,自从他们的儿子乔伊在1974年被诊断出患有该病后,他们就与CFF合作。那是一个残酷的开始。检测被搞砸了,儿科医生以前没见过囊性纤维化婴儿,乔伊无法进食,每次试图从奶瓶里吸奶都会窒息。
经过三个痛苦的月后,另一位熟悉囊性纤维化的儿科医生终于做出了诊断。这个消息是毁灭性的;当时,囊性纤维化患儿很少能活过5岁。但在正确诊断后,乔伊的胃里插入了一根喂食管,以输送预消化的食物,绕过咳嗽和作呕,他的情况开始好转。
“与前八个月相比,接下来的五年几乎是一场派对,”他的父亲说。“他好转了,他是一个了不起的孩子。”
到12岁时,乔伊是他七年级班级的班长,一个爱搞恶作剧的人,一个A等生,还是一个弹球高手。“他喜欢女孩,”他的母亲笑着补充道,“他喜欢棒球。”
然而,住院治疗变得更加频繁,也更加严重。很多次他们被告知,“他活不过今晚了,”他的父亲说,“但他总是挺过来了。”除了他没挺过去的那次。他于1986年去世。他当时12岁半,体重不到50磅。
六个月后,奥唐奈夫妇和他们的密友一起发起了乔伊基金,为囊性纤维化研究筹集资金。到2001年,该基金筹集了近5000万美元。为了继续药物研究,比尔需要更多资金——确切地说是1.75亿美元——他请求曾是董事会成员的乔来筹集这笔钱。
奥唐奈承认这是一场奇怪的筹款活动。“我就是这么宣传的。我们不命名任何东西,不捐赠任何东西。我们把你给的每一分钱都投入到研究中,”他解释道。“而且猜猜怎么着,我们最终可能一无所获。但可以肯定的是,如果我们不这么做,我们肯定会一无所获。所以这就是全部的演讲。”
奥唐奈坚持纯粹的风险慈善,而非风险投资。如果有利息和其他利润,他希望那笔钱能滚入更多的研究,而不是进入某个人的口袋。没有其他基金会曾以这种方式成功资助过一项治愈方案。但正如所有认识他的人所说,他有天赋,他筹集到了资金。这至关重要,因为福泰制药正在取得进展。
在2002年和2003年,福泰制药的圣地亚哥工厂(负责药物筛选)测试了另外20万种化合物,其中有几种看起来很有希望。最优秀的候选药物——分别被命名为VX-770和VX-809,即门卫药物和校正剂药物——使内古列斯库检测中的突变囊性纤维化细胞发出荧光蓝色,这是氯离子正在移动的迹象。“那时我们变得很兴奋,”内古列斯库说,他被并入福泰制药,负责圣地亚哥的筛选工作。
为了测试门卫药物VX-770,研究人员使用了来自一名患有G551D突变的囊性纤维化患者的肺细胞——这种突变与奇弗斯姐妹的病因相同,她们只需要一种门卫药物就能恢复健康模式。VX-770使细胞发出蓝色光,证明氯离子通道已经打开。仔细观察细胞后,内古列斯库明白了原因:肺细胞表面覆盖着细小的毛发状结构,称为纤毛。在健康人中,这些纤毛来回摆动,将粘液扫出肺部。然而,在囊性纤维化细胞上,纤毛被粘液粘住,就像铺满胶水的长毛地毯。
当内古列斯库通过显微镜观察实验室培养皿中生长的患病G551D肺细胞时,它们看起来像一堆静止的小灰色球体。但当他的同事们用VX-770处理这些患病细胞时,这些微小的毛发恢复了生机。在显微镜下,他能看到纤毛来回摇摆,就像体育场里的人群在做人浪。随着纤毛的摇摆,细胞开始振动,仿佛喝了咖啡。他想,有了活跃的氯离子通道,粘液会变得像健康人一样稀薄,复活的纤毛就能把它清除掉。
“这给了我们如此大的乐观,有些人激动得哭了,那太美了,”内古列斯库说。也许VX-770也能在活体患者中起到同样的作用。
到2007年,该药已在细胞和健康志愿者的I期临床安全性试验中进行了测试。VX-770正在成为药物Kalydeco的路上。
针对G551D突变患者的II期试验规模很小,只有39名患者,但设计得非常巧妙,以便尽可能多地获取数据。2008年春,福泰公司的首席医生向奥尔森展示了一些数据;他看到的几个数字胜过千言万语。“这太了不起了,”奥尔森说。仅仅两周后,汗液中的盐浓度就从大约100毫摩尔——这是CFTR蛋白功能失常时的典型值——骤降至大约50到60毫摩尔,虽然比平均值稍高,但已低于囊性纤维化的诊断标准。
然后,在2010年,作为III期试验的一部分,VX-770被给予患有G551D突变的患者,包括奇弗斯姐妹劳拉和凯特。“对于一位制药科学家来说,这是一生一次的机会,”项目负责人奥尔森说。“我们不仅仅是在治疗症状。我们正在修复真正导致这种疾病的蛋白质。”
劳拉开始试验时并不知道自己服用的是药物还是安慰剂。她持续咳嗽,体重无法增加,最终发展成严重的肺部感染,需要使用强效抗生素。
对凯特来说,情况则不同。“我能感觉到自己越来越好,长得更高,我能看到我和劳拉之间的区别,”凯特说,她咳嗽减少,睡眠改善,体重增加,食欲大增,精力充沛。后来,一直在服用安慰剂的劳拉被换成了药物,她也康复了。美国食品药品监督管理局(FDA)于2012年批准了该药。
专家们一致认为,对于患有奇弗斯姐妹那种囊性纤维化类型的患者来说,这种治疗是变革性的。“我们才刚刚开始在实践中使用它,”波士顿儿童医院囊性纤维化中心主任、儿科肺科专家亨利·多尔金说。“虽然现在还为时过早,但结果非常令人鼓舞。”
多尔金从医超过35年,他办公室的窗台上摆满了孩子们的照片——他治疗过的病人,其中许多人死于这种疾病。患者通常每年会损失大约1%或2%的肺功能。如果这种下降速度减缓或停止,并且他们继续增重,那么多尔金说,“我不得不说这是一个改变游戏规则的因素。”
劳拉和凯特每天服用两片Kalydeco的费用是841美元;每年就是307,000美元,这使其成为世界上最昂贵的药物之一。在大多数情况下,私人保险会承担这笔费用。联邦医疗保险或医疗补助也可能支付。对患者自己而言,一个月的药物供应费用约为15美元。对于没有保险的患者,福泰公司提供经济援助,以便他们能够获得该药。
公司负担得起这种慷慨:Kalydeco在2012年实现了1.72亿美元的意外利润,提升了公司的股价和知名度。尽管许多人质疑这笔利润的道德性以及药价给医疗保健系统带来的负担,但比尔表示,没有福泰公司,就不会有这种药。而且,对于CFF来说,在药物问世之前就谈判药价,会是一个交易的破坏者。
CFF也从Kalydeco的发现和销售中获利。它刚刚出售了该药的部分版税权,带来了1.5亿美元。按照奥唐奈坚决支持的商业计划,这笔钱将全部重新投资于更多的囊性纤维化研究和药物开发。这很重要,因为比尔并不满足于将Kalydeco视为治愈方法。
“在谈论Kalydeco时,我们需要谨慎使用‘治愈’这个词,尽管这种药显然改变了游戏规则,并在囊性纤维化社区——以及我个人——中燃起了巨大的乐观情绪,”比尔说,“但我们必须谨慎。我们只有两年的患者用药数据,现在说这对他们来说是否会是治愈还为时过早。”
的确,即使服用了Kalydeco,凯特和劳拉每天仍然需要服用20到30颗药丸来消化食物。她们还需要30分钟的物理治疗——拍打和敲击她们的侧面和背部——以帮助排出粘液。但她们没有肺部感染,体重也在增加。
完成治愈
那些拥有两个Delta F508突变拷贝的患者——占囊性纤维化人口的一半——正在关注奇弗斯姐妹,看这种治疗是否能继续发挥其魔力。他们正在等待福泰制药公司进行的第二种药物,即校正剂VX-809与门卫药物Kalydeco联合使用的III期试验,看有缺陷的蛋白质是否能到达细胞表面并打开门,让氯离子再次流动。如果成功,这种药物组合可能会为大多数患者的疾病进程踩下刹车——就像Kalydeco似乎为劳拉和凯特所做的那样。
希望是有理由的。福泰公司组合试验的II期显示,VX-809加Kalydeco改善了携带两个Delta F508突变拷贝患者的肺功能。这项更大、更长的III期研究将涉及1000名患者,持续24周,预计将在2014年得出结果。
比尔并没有把所有的赌注都押在福泰公司上。奥唐奈已经开始了另一项7500万美元的筹款活动,以资助其他制药公司。基金会已经向辉瑞公司投资了5800万美元,用于开发第二代类似但更有效的药物,以治疗携带两个Delta F508突变拷贝的患者。
虽然Kalydeco和校正剂应该有效,但福泰公司或其他公司最终可能能够设计出更有效的分子。而且比尔仍然担心那40%的患者,他们只有一个Delta F508突变的拷贝和另一个突变的拷贝:Kalydeco和校正剂组合在这个群体中会有多有效?
所以,探索仍在继续。“我们不会满足于少于100%的患者,”他说。
为此,福泰制药正在扩大临床试验,以涵盖其他罕见突变。R117H突变,由约3%的囊性纤维化人群携带,会产生一种能到达细胞表面目的地的蛋白质,但随后功能失常。虽然障碍尚不清楚,但奥尔森猜测可能是门卡住的问题。
如果是这样,就像奇弗斯姐妹的G551D突变一样,Kalydeco或许能修复这个缺陷。奥尔森补充说,还有两种校正剂药物正在研发中,VX-661和VX-983。“你想让你的巢里装满各种分子,每种分子都有略微不同的特性,”他说。携带不同突变的人可能需要特定的校正剂,或者不止一种校正剂,或者这些药物的复杂组合,这就是福泰制药继续其探索的原因。
“罗伯特·比尔在一个很可能失败的项目上押下了一个巨大而昂贵的赌注,他理应获得很多赞誉,”现任NIH主任柯林斯说。CFF的策略是攻击其他遗传性疾病的一个有前途的模型,柯林斯补充道,其他组织也在尝试采纳这种创新的药物开发模式。
CFF可能很快就会成功创造出一种长期寻求的治愈方法,但对奥尔森和内古列斯库来说,这段旅程是苦乐参半的。在过去的15年里,科学家们已经融入了囊性纤维化社区。他们参加了筹款步行和烘焙义卖活动。他们结识了前来福泰公司分享故事和参与研究的囊性纤维化家庭。一路走来,他们经历了许多损失。奥尔森描述了一个家庭,在过去三年里失去了三个孩子。“对那个家庭来说,我们还是不够快。”
每年,囊性纤维化基金会(CFF)都会在不同的城市举行年会,在过去的十年里,乔·奥唐奈与许多成员都非常熟悉——志愿者、失去孩子的母亲,以及其他正处于关键时刻的人。2012年10月,在佛罗里达州奥兰多,有近4000人拒绝放弃为治愈而努力,同时一直想知道这对他们来说是否真的会发生。
寻找治愈方法时间线
1955年 — 囊性纤维化基金会(CFF)成立。
1978年 — 内科住院医师弗朗西斯·柯林斯在被指派照顾一名新诊断的19岁囊性纤维化患者时,对该病产生了兴趣。
20世纪80年代初 — 科学家们发现了亨廷顿舞蹈病的DNA标记。这使得研究人员相信他们可以使用类似的方法来找到导致囊性纤维化的基因。
1985年 — 多伦多大学的徐立之将囊性纤维化基因追踪到7号染色体。
1987年 — 徐立之和柯林斯联手。
1989年 — 徐立之和柯林斯鉴定了在囊性纤维化患者中发生突变的囊性纤维化跨膜调节因子基因(CFTR)。
1990年 — 柯林斯和詹姆斯·威尔逊制造出一种能够携带CFTR基因的病毒。他们希望这种病毒能将基因传递给人类患者。
1993年 — 囊性纤维化的基因疗法在狒狒身上取得成功,但在人类身上完全失败。
1994-1996年 — 柯林斯的重点转移到在NIH对整个人类遗传密码进行测序。他放弃了囊性纤维化的研究。罗伯特·比尔成为CFF的首席执行官,并认识到基因疗法的局限性,向奥罗拉生物科学公司投资320万美元,细胞生理学家保罗·内古列斯库开始使用高通量方法测试大量潜在药物,寻找化学疗法。
1999年 — 威尔逊公布了I期试验结果,表明在没有免疫排斥的情况下,将CFTR基因导入囊性纤维化患者的肺细胞几乎是不可能的。
2000年 — CFF向奥罗拉生物科学公司提供4400万美元用于寻找治愈方法,并成立了一个名为囊性纤维化基金会治疗公司的分支机构来领导研究。
2001年 — 奥罗拉生物科学公司被福泰制药公司收购。内古列斯库留任,比尔招募乔·奥唐奈帮助筹集1.75亿美元以维持项目进展。
2002-2003年 — 福泰公司在测试的20万种化合物中发现了有希望的候选药物,包括VX-770(门卫药物)和VX-809(校正剂药物)。
2007年 — VX-770通过I期安全性试验。
2010年 — 劳拉和凯特开始VX-770的临床试验。
2012年 — VX-770获得FDA批准,并更名为Kalydeco。
2013年 — 福泰公司正在进行校正剂药物VX-809与门卫药物Kalydeco联合使用的III期试验。
[本文最初以“治愈之门”为题发表于印刷版。]