二十世纪初,丹尼斯克美国公司的微生物学家遇到了一个问题:他们用来生产酸奶和奶酪的细菌感染了病毒。深入研究后,科学家们发现,一些细菌拥有一种防御系统来对抗这些病毒入侵者。这些抗病毒细菌在其染色体中携带奇怪的、重复的DNA字母序列——这是它们与过去病毒遭遇后,“储存”在自身基因组中的DNA片段。这是一种分子记忆,类似于我们自身的免疫系统记住入侵者以便在反复感染时产生抗体。
在这种情况下,被称为CRISPR-Cas(或简称CRISPR)的微生物免疫系统会粉碎任何与它们分子记忆库中的序列匹配的病毒基因组。这些生产商当时并没有寻找生物技术领域的“下一个重大工具”,他们只是想保存罐中的产品。但其他科学家很快意识到CRISPR在他们自己的设计中的潜在价值:通过一些修改,CRISPR允许他们切割任何想要的基因序列,极大地减轻了基因工程的挑战。CRISPR系统席卷了生物技术界,获得了诺贝尔奖,并开启了基因治疗的新时代。2023年12月,美国食品药品监督管理局批准了首个基于CRISPR的基因改变治疗方法:一种针对极其痛苦的血液疾病镰状细胞贫血症的新基因疗法。“这对研究来说是革命性的,”麻省理工学院媒体实验室的进化工程师Kevin Esvelt说。“它正在加速整个生物技术的发展。”

二十世纪后期,传统的基因疗法得到了测试,但毒性和癌症是主要的障碍。CRISPR系统最早是在细菌中发现的,现在这项技术已成功应用于人类基因疗法。
自从科学家们发现CRISPR以来,一直存在一个令人不安的问题:在动物、植物和真菌——也就是所谓的真核生物(以储存遗传物质的细胞核为特征)中,是否存在类似的基因改变系统?
现在,根据2023年6月发表在《自然》杂志上的一篇由麻省理工学院和哈佛大学博德研究所分子生物学家Feng Zhang及其同事撰写的论文,答案是肯定的。该团队在多种多样的真核生物中发现了被称为Fanzors的CRISPR样DNA剪刀,包括真菌、藻类、变形虫和一种名为北方蛤的蛤蜊(发音为coe-hog)。
研究人员称这一发现是对CRISPR家族树的一个迷人补充。这一发现引发了更多问题:Fanzors是做什么用的?它们也能在生物技术领域掀起波澜吗?Fanzor和CRISPR是否只是冰山一角,还有更多有待发现的DNA切割系统?
以下是我们对微生物CRISPR系统和后来出现的Fanzors的一些了解。
什么是CRISPR?
仅仅将DNA切碎并没有什么特别之处。CRISPR系统的独特之处在于它只在精确的目标位点进行切割。这需要两个要素:一个是定位器,一段短的RNA,它与目标DNA序列匹配。另一个是“剪刀”蛋白(一种酶)。微生物已经进化出了几种用于切割的酶,名称如Cas9和Cas12。
当微生物被病毒感染时,它们会收集病毒遗传序列的小片段,并将它们存储在基因组中一个名为CRISPR重复序列的区域。下次当该病毒出现时,微生物就可以利用这些序列生成引导RNA。然后,它们可以使用酶“剪刀”来剪断病毒的遗传物质,从而进行防御。
已知的大约一半细菌,以及大多数其他被称为古菌的微生物,都拥有CRISPR-Cas系统。奇怪的是,甚至一些病毒也“劫持”了CRISPR-Cas机制来对抗微生物。因此,直到这项新研究之前,真核生物是唯一未被纳入其中的群体。
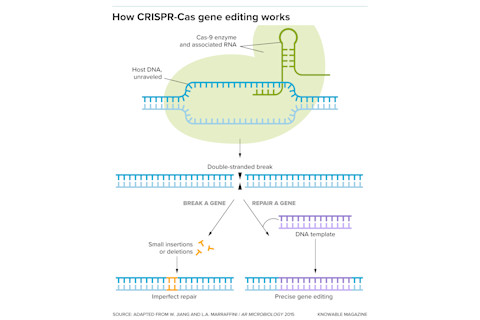
在CRISPR-Cas基因编辑中,Cas9酶使用相关的RNA片段与DNA基因组的某个部分结合。然后,酶会切断DNA的两条链。细胞会修复这种断裂——要么不完美地修复,产生一个断裂的基因(左侧),要么利用提供的DNA模板,实现可控的改变(右侧)。
CRISPR为生物技术提供了什么?
所有生物都使用相同的基本DNA密码和蛋白质,因此CRISPR-Cas系统理论上可以适用于科学家将其放入的任何生物体——尽管实际上通常需要一些调整。
最简单的应用是切除不需要的DNA。一旦Cas酶切割了目标基因,细胞会将其粘合在一起,但修复过程不完美,会产生一个断裂的基因。对于某些应用来说,破坏基因就足够了,这也是一种可能的镰状细胞基因疗法方法。
镰状细胞贫血症发生在身体携带缺陷的血红蛋白基因时。但身体还有一个在胎儿期使用的独立血红蛋白基因。科学家们希望重新激活成人血细胞中有效的胎儿血红蛋白。另一个基因BCL11A会使胎儿血红蛋白基因保持沉默。新的FDA批准的治疗方法使用CRISPR来破坏BCL11A,从而使功能正常的胎儿血红蛋白在成人细胞中重新活跃起来。FDA还在2024年1月批准了这种治疗方法用于治疗血液疾病β-地中海贫血症。
通过一些额外的分子技巧,研究人员还可以利用CRISPR添加新的遗传序列或修复断裂的基因。
科学家们还正在试验基于CRISPR-Cas的疗法,用于治疗糖尿病;一种形式的淀粉样变性;包括艾滋病毒在内的感染;以及多种癌症。这还不是全部。研究人员正在将CRISPR应用于将猪变成人类可能的器官供体,创造更高质量、抗病的水果,以及根除传播疟疾的蚊子。
也存在弊端。在人体中切断DNA链是一项有风险的工作:如果Cas切割到错误的位置或修复过程出错,治疗可能会以某种方式改变基因组,从而引发癌症。因此,许多现代CRISPR方法使用Cas蛋白的改良版本,它们不完全切割DNA,而是更微妙、更安全地进行编辑。
Fanzor是如何被发现的?
UC Davis的遗传学家David J. Segal说,Fanzor“一直隐藏在显眼的位置”。他在2013年为《基因组学与人类遗传学年鉴》撰写了关于基因组工程新时代的文章。Fanzor基因在同年首次被描述,但没有人知道它们编码了Cas样酶。
加州库比蒂诺基因信息研究所的研究员Weidong Bao是2013年Fanzor研究的合著者。他和他的同事当时并不是在寻找DNA剪刀,而是对所谓的“跳跃基因”感兴趣。这些是DNA序列,它们可以从基因组的一个位置“跳跃”到另一个位置重新插入。这些元素最著名的例子,正式名称为转座子,是控制玉米籽粒颜色的跳跃基因——这项工作为遗传学家Barbara McClintock赢得了诺贝尔奖。事实上,人类基因组中约有一半由转座子组成,但不必担心:大多数已经不再跳跃了。
Bao知道细菌的跳跃基因通常含有一个功能未知的基因,称为TnpB。他寻找类似的基因,并在二十多个真核生物的基因组中发现了它们,包括一种苍蝇、酵母、霉菌、变形虫和几种藻类。研究人员将这种神秘基因的真核生物版本命名为Fanzor,而不是TnpB。
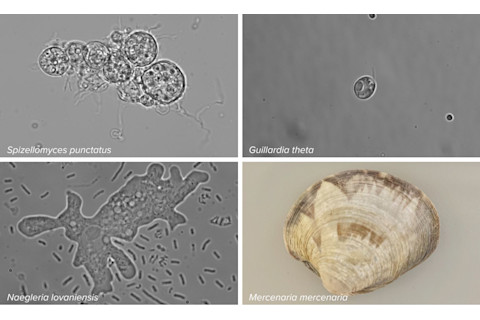
研究人员在多种真核生物中发现了Fanzor基因。从左上顺时针方向:土壤真菌Spizellomyces punctatus,藻类Guillardia theta,北方蛤Mercenaria mercenaria,以及变形虫Naegleria lovaniensis。图片来源:M. SAITO ET AL / NATURE 2023
在2021年的一项研究中,Zhang及其同事也偶然发现了Fanzor。他们当时正在构建一个CRISPR-Cas家族树,展示这些RNA引导的切割系统是如何进化的,因此他们扫描了来自不同生物体的基因和蛋白质,寻找相似的成分。他们发现Fanzor是细菌Cas基因的表亲,并且这两个基因家族都源自TnpB。
Fanzor基因是否像CRISPR-Cas系统一样参与DNA切割?
Zhang及其同事推断,如果Fanzor基因和CRISPR系统中发现的Cas基因是失散多年的表亲,那么Fanzor基因也可能携带可以切割DNA的蛋白质的指令。进一步遵循这一假设,Fanzor蛋白也可能使用RNA引导来寻找和切割特定的DNA序列。
于是,他们通过在培养皿中的人类肾细胞中释放Fanzor基因进行了测试。这些基因被翻译成Fanzor蛋白。然后,科学家们将引导RNA引入这些Fanzor蛋白,并让它们孵育三天。如果Fanzor蛋白是一种DNA切割酶,细胞就会不完美地将DNA重新粘合,在与引导RNA匹配的位点产生奇怪的缺失或插入。这正是该团队所发现的。
是的,Fanzor是一种真正的、RNA引导的DNA切割酶。
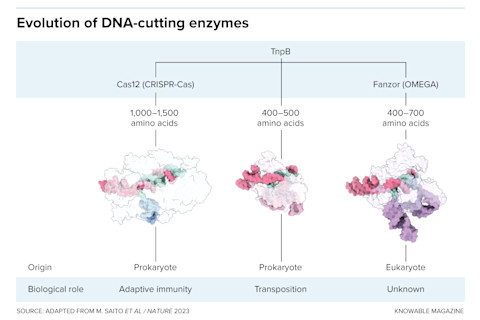
TnpB基因是基于Cas和Fanzor的DNA切割系统的祖先。
Fanzor会补充还是取代生物技术中的CRISPR-Cas?
在培养皿中切割几个基因距离成为生物技术的下一个重大工具还有很长的路要走。到目前为止,Zhang团队做得最好的就是以18.4%的成功率切割目标基因位点,而且他们还没有尝试用它来修复有缺陷的基因。这远不如CRISPR-Cas,后者拥有多年来科学家们优化系统的优势。
Fanzor相较于CRISPR-Cas的一个潜在优势是其小巧的尺寸。Cas酶加上引导RNA,以及可能需要的其他元件,要将其递送到想要改造的细胞中是一项大工程。科学家们经常将这些成分装入一种良性病毒进行递送,但所有这些元件都无法放入最常用的病毒中。更小巧的Fanzor酶更适合。不过,科学家们已经设计出了Cas12和Cas13酶的微型版本,它们可以装入病毒中。所以在这方面两者打成了平局。
Esvelt说,Fanzor在基因工程方面存在一个潜在的劣势。CRISPR-Cas系统通常需要引导RNA与一段约18到20个基因单位(碱基)长的DNA序列匹配。Esvelt计算,在基因组中,这种完美的匹配序列可能不超过一个。这意味着Cas酶不太可能在目标位点以外的任何地方切割基因组——这对安全的基因疗法来说是个好消息。但Fanzor只需15个DNA碱基就能匹配。
Esvelt说,更小的序列很有可能在基因组中重复出现多次。那样的话,Fanzor就会切割目标位点,但也会切割其他相同的位点,这可能给基因疗法带来灾难。优势:CRISPR-Cas。
事实上,CRISPR在大多数生物体中“运行良好”,英国诺维奇Sainsbury实验室的植物病理学家Sophien Kamoun说,他曾审查过CRISPR在工程作物植物中的应用。但Kamoun建议,Fanzor对于那些在某些细菌中Cas酶有毒性的科学家来说可能仍然有用。
因此,总体而言,大多数CRISPR-Cas实验室没有理由更换。“我更愿意使用我们已知的东西,”Segal说,他正致力于治疗神经发育障碍。“我所做的事情本身就有足够的神秘之处,我不需要担心使用一种新酶。”
Fanzor系统在自然界中做什么?
尽管如此,Fanzor是一项非常酷的生物学发现。“令人着迷的是,生命王国中有如此多的CRISPR样系统,”Esvelt说。
虽然我们知道CRISPR-Cas系统对微生物有什么作用,但尚不清楚Fanzor蛋白在自然界中确切的作用。研究人员认为它们以某种方式与转座子配对——也许是在帮助它们,或者只是搭便车。
Zhang团队曾考虑的一种可能性是,Fanzor可能为转座子创建了一个防御系统。毕竟,一个能够进出基因组,并在每次进行时改变DNA的DNA片段,对细胞来说通常是不好的,所以细胞可能会反击。这种假想的基于Fanzor的防御可能如下工作:转座子会跳跃到基因组中与它关联的Fanzor喜欢切割的遗传序列相同的位点。通过跳跃到该位点,转座子会破坏Fanzor的目标位点,从而保护细胞基因组不被切割。
但如果细胞移除了转座子,它就会重新创建Fanzor目标位点,使其基因组再次容易受到Fanzor的切割作用。
张推测,本质上,转座子会告诉细胞:“如果你摆脱了我,我会去别的地方,我会制造Fanzor酶,它会回来切碎你赶我出去的位点。”因此,最好还是让转座子留在原地。
但这只是一个可能性。
张说,人类是少数不自然拥有Fanzors的生物之一。但人们仍然可能拥有Fanzor-Cas家族中其他类似的DNA切割系统。Zhang的研究小组正在积极寻找新的。“我们正试图发现尽可能多的,”他说。
10.1146/knowable-012224-1
Amber Dance是洛杉矶地区的一名自由科学记者。
本文最初发表于《Knowable Magazine》,这是一个独立的、来自Annual Reviews的新闻项目。