1992年6月的一个下午,名叫马修·夏普的舞者死了八次。警笛尖叫着,他反复倒在街上,让陌生人围绕着他的身体画上粉笔轮廓。然后他站起来,拿起粉笔,每次都在空白处写下他伴侣约翰尼·富兰克林的名字——就像犯罪现场的警察一样。
富兰克林两年前在俄克拉荷马城死于艾滋病,现在夏普正与艾滋病宣传团体“采取行动”(Act Up)一起,沿着旧金山每年一度的同性恋骄傲大游行中的市场街行进。“假死抗议在1980年代和1990年代是艾滋病行动主义的常见形式,”夏普回忆道。“我们游行时每七分钟就完全沉默地进行一次,因为当时每七分钟就有一人死于艾滋病。”
富兰克林去世后,夏普因患肺外结核病差点成为又一个受害者。“我觉得自己快要死了,”他说。“所以我辞去了芭蕾舞团的工作,拿走了约翰尼留给我的寿险金,搬到了旧金山,那里是艾滋病病毒的重灾区。在接下来的20年里,我通过参与新药临床试验得以幸存,这些新药在发布前都会进行试验。我积极预防机会性感染。当我开始死于消瘦综合征时,我参加了一项人类生长激素的试验。我接受了实验性胸腺移植。2008年的联合疗法最终使我的病毒载量降至检测不到的水平。”
然而,夏普的T细胞仍有问题——T细胞是白细胞或淋巴细胞,它们对艾滋病病毒等病原体发动强大的免疫反应。对于艾滋病,最关键的T细胞是CD4,它通常会协调身体对疾病的攻击。但由于生物学上的一个怪癖,CD4细胞最终会隔离病毒,病毒最终会摧毁它们。夏普的CD4细胞计数徘徊在每立方毫米血液250个左右——正常计数是500到1500——他容易感染多种机会性感染,并符合全面艾滋病诊断的条件。“我总是在危险区,每年我都会患肺炎,”夏普说。
随后,他收到了一份参与新型基因疗法的邀请,这种疗法可能标志着朝着真正治愈艾滋病迈出的第一步。这项试验由旧金山Quest临床研究中心主任杰伊·拉莱扎里(Jay Lalezari)负责。夏普同意加入。他的血液被抽取,CD4细胞被过滤、冷冻,并运送到一个实验室,在那里它们被基因改造以抵抗艾滋病病毒的入侵。这是通过删除CD4细胞表面艾滋病病毒用来进入的受体来实现的。经过基因改造的CD4细胞在实验室中增殖,然后返回给拉莱扎里。
2010年9月,夏普接受了一次性输注200亿个基因工程免疫细胞。几周之内,他的CD4计数翻了一番。“他们每月都给我做检查,我的CD4计数从未低于400。自从这次治疗以来,我没有再犯过往常的肺炎。我很想再输注一次,”夏普说。“我今年55岁了,感觉比以往任何时候都好,现在我有机会在有生之年真正看到艾滋病病毒被完全治愈。”
治愈艾滋病?消灭目前全球影响3300万成人和250万儿童,并且每天感染7000新人的流行病?自从科学家识别艾滋病病毒是艾滋病病因以来的30年里,这种病毒已被证明是无法战胜的——它藏匿于本应杀死它的免疫细胞中;它反射性地快速变异;它神秘地存在于肠道、肾脏、肝脏和大脑中;它挫败了所有疫苗(迄今为止最好的疫苗只提供了30%的保护);而且一旦停药,它几乎立刻就会卷土重来。多年来,没有人敢再提及“治愈”这个词。
但他们再次大胆尝试,信心日增,这得益于新的见解和技术,以对抗艾滋病病毒共同发现者杰伊·利维(Jay Levy)称之为“生物特洛伊木马”,杰伊·拉莱扎里(Jay Lalezari)称之为“首先杀死你的急救人员的细胞生物恐怖分子”的敌人。研究人员利用从基因疗法到干细胞的医学进步,对病毒发动了强大的反击。美国国立卫生研究院(NIH)将在未来五年内投入7000万美元,支持三项旨在寻找治愈方法的多机构研究工作。而以其会议闻名的独立国际艾滋病学会,已经组建了一个世界专家工作组,牵头制定全球治愈战略。
这一最新进展似乎与1996年患者庆祝的那个突破一样引人注目,当时纽约洛克菲勒大学的戴维·何(David Ho)展示了他的联合药物疗法研究,这种治疗鸡尾酒能使病毒在血液中检测不到。这项工作几乎在一夜之间将艾滋病从一种必死无疑的疾病转变为一种慢性病。“我记得亲眼目睹了一个奇迹,”加州大学旧金山分校(UCSF)艾滋病病毒发病机制专家史蒂文·迪克斯(Steven Deeks)回忆道。“ буквально几周内,人们从死亡判决走向了多年的健康承诺。安宁病房的病人被送回家。现在,我们有可能迎来另一次戏剧性的转变。”然而,他警告说,从第一种抗病毒药物到真正有效、耐受性良好的联合疗法,“花了15年。我认为就彻底治愈而言,我们现在才开始另一个15年的旅程。”
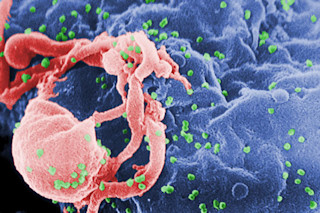
我们能够战胜艾滋病病毒的希望再次燃起,这尤其令人瞩目,因为我们对这种极其复杂和狡猾的逆转录病毒了解甚多——之所以称之为逆转录病毒,是因为它通过逆转大多数其他病毒使用的分子过程来复制。在大多数情况下,病毒以DNA作为其主要遗传物质,并制造自身的RNA模板。逆转录病毒则相反,它们以RNA为起始,利用一种名为逆转录酶的酶制造DNA模板;由此产生的DNA随后利用人类细胞机制产生更多的病毒拷贝。艾滋病病毒最喜欢的目标是CD4 T细胞,它协调我们对疾病的整个免疫反应。病毒通过细胞表面的一些受体——或分子通道——进入CD4细胞,其中包括一个关键的名为CCR5的受体。然后它掠夺该细胞的逆转录酶供应。如果CD4细胞处于静止状态,艾滋病病毒也随之静止。但如果CD4细胞被任何事物激活,从压力到普通感冒,内部的艾滋病病毒也会变得活跃,产生DNA模板并整合到CD4细胞内的人类基因组中。CD4细胞非但没有像对待其他病毒那样杀死艾滋病病毒,反而制造了
仅CD4循环就足以致命,但艾滋病病毒也会进入其他细胞,整合到它们的基因组中。潜伏的病毒潜藏着,看似休眠,实则等待着它的信号:任何能刺激免疫系统的东西——工作压力、食物中毒、悲伤——都能促使艾滋病病毒斗士们行动起来。一些科学家怀疑,这种潜伏病毒库导致了艾滋病病毒感染者常常经历的长期炎症,即使他们正在接受控制疾病的药物鸡尾酒疗法。随着时间的推移,潜伏的艾滋病病毒可能会悄无声息地造成破坏,使得随着时间的推移,对真正治愈的需求变得更加紧迫。
最近的研究阐明了何氏联合用药方法的局限性。2008年发表在《柳叶刀》上的一项多国研究发现,一名20岁开始接受艾滋病病毒治疗的人预期寿命为49岁,比没有该疾病的人减少了27年。还有医生所称的神经艾滋病。即使接受抗逆转录病毒治疗,仍有40%到60%的艾滋病病毒感染者会出现轻度神经功能障碍;1%到5%的人会发展为痴呆症。最近的一项研究表明,这种综合征是由于艾滋病病毒损伤星形胶质细胞(大脑中最常见的细胞类型)的方式造成的。在艾滋病患者中,约5%的星形胶质细胞被感染;一些科学家推测,这些细胞反过来会喷出毒素,最终杀死附近未感染的星形胶质细胞。
此外,今天的药物疗法专门针对目前的艾滋病病毒毒株,但病毒可能会变异,就像所有病毒最终都会变异一样。“我们不能自满,”现任加州大学旧金山分校(UCSF)肿瘤和艾滋病病毒研究实验室主任的杰伊·利维(Jay Levy)说。“在世界其他地区,这是一种活跃的、未经治疗的流行病。它可能会改变并以新的形式卷土重来困扰我们。”
在加速寻找艾滋病治疗方法的过程中,医学研究人员正在积极探索三种主要方法。第一种方法是基因疗法,即将患者的细胞进行基因改造,使其对艾滋病病毒免疫;这种天然抵抗力已在全球1%的白种人中存在。第二种方法涉及潜伏激活剂,即引诱病毒从其藏身之处暴露出来的分子,这样身体的免疫细胞和靶向药物就能够一劳永逸地找到并摧毁它。最后,科学家们正在深入研究一群被称为“精英抑制者”的独特人群的免疫系统,他们在感染艾滋病病毒后仍保持健康,将病毒控制数十年。
实验室和患者试验中令人印象深刻的进展使得这三种策略都看起来很有希望,但最终可能不会有单一的治疗方法。与今天的药物鸡尾酒疗法一样,最好的解决方案可能是两种或甚至所有三种的组合。即使是“治愈”的概念也可能需要调整。由于要对体内每个细胞是否存在艾滋病病毒进行检测将是极其困难的,因此如果患者在治疗结束后的一段时间内没有疾病证据,则将被视为已治愈。对于数百万患者来说,这将是一个改变生活、肯定生命的事件。
任何幸运到完全抵抗艾滋病病毒感染的人,其CD4细胞表面很可能缺乏CCR5受体。这种天然保护性突变的存在于1996年首次在《自然》杂志上报道。当格罗·许特尔(Gero Hütter)——他如今是德国曼海姆输血医学与免疫学研究所的血液癌症专家——读到这篇文章时,他着迷了。“我想,哇,这可能是一种治疗艾滋病病毒的方法。”
但要让不是天生具备这种抵抗力的人获得这种能力,是一项艰巨的任务。它需要通过清除现有细胞并施用具有艾滋病病毒抵抗力的干细胞来重建免疫系统,这些干细胞能够建立一个新的免疫系统。鉴于药物鸡尾酒疗法的有效性,许特尔不会仅仅为了艾滋病而考虑如此冒险的程序。但如果他正在为一名同时患有艾滋病的癌症患者进行干细胞移植,他认为,那为什么不使用具有CCR5缺失的干细胞呢?“然后我就把它忘了,”他说,“因为我从未遇到过我可以尝试的病人——直到蒂莫西·雷·布朗出现。”
布朗是今天唯一一位被治愈艾滋病病毒的人。用加州大学戴维斯分校干细胞研究员格哈德·鲍尔(Gerhard Bauer)的话来说,他是“世界上第一个针对艾滋病病毒的天然基因疗法实验”。他于2006年前来找许特尔——当时许特尔在柏林的夏里特大学医院工作——他患有白血病,并且艾滋病病毒感染通过联合抗逆转录病毒疗法得到了很好的控制。在癌症化疗失败后,布朗需要进行干细胞移植以治疗白血病。医生们的计划是用强化化疗杀死布朗的癌细胞骨髓细胞,并用健康捐赠者骨髓中的干细胞替换它们。许特尔查阅了多个捐赠者登记册,并检测了200多名候选人的血液,寻找天生带有CCR5突变的人。运气站在布朗这边:一位匹配的捐赠者确实有这种缺失。布朗接受了干细胞移植,并停止服用抗逆转录病毒药物。在随后的60天里,他的基因组中仍有病毒DNA的迹象,但随后似乎消失了。“艾滋病病毒库的清除速度相当快,”许特尔说,他在2011年听起来就像2007年一样惊讶。
一年后,布朗的癌症复发,他接受了另一次来自同一捐赠者的干细胞移植。如今,他已摆脱癌症和艾滋病病毒。许特尔推测,布朗之所以能完全治愈,得益于所谓的宿主抗移植物反应:新的干细胞及其所有后代将旧免疫细胞视为“异己”并将其清除。当这种情况发生时,所有永久整合到这些细胞基因组中的艾滋病病毒潜伏库也可以被清除。布朗现在正在旧金山接受杰伊·利维及其同事的研究。“能够找到一个曾患艾滋病并现在似乎已清除病毒的人,这是非凡的,”利维说。
然而,治愈布朗艾滋病病毒和癌症的治疗方法存在一些潜在的灾难性弊端。首先,移植的捐赠细胞可能会像捐赠心脏一样被排斥,使患者面临疾病风险,并且通常需要强效免疫抑制剂,伴随所有相关的副作用和风险。鉴于目前的艾滋病药物鸡尾酒疗法如此有效,除非像布朗一样,患者无论如何都需要骨髓治疗,否则这种危险是不可接受的。
在布朗惊人康复的基础上,但为了避免潜在的弊端,艾滋病研究人员正在设计基于患者自身组织的治疗方案,这样就不会像供体细胞那样面临排斥风险。其中最有前途的方法之一是使用一种新型基因剪刀,称为锌指核酸酶,由加利福尼亚的Sangamo Biosciences公司开发。这些指状蛋白质在特定氨基酸(蛋白质构建模块)与带电锌原子结合时形成。它们可以被设计成进入细胞并剪切研究人员希望靶向的任何基因(包括T细胞受体CCR5的基因)。受损细胞会自动开始修复切口,但在25%的情况下,这种努力会失败,被删除的基因永远无法恢复。这些细胞可以被分离出来,从而创建了一个缺乏CCR5的艾滋病病毒抵抗性细胞库。然后,这些实验室工程细胞可以被扩增和培养百倍或更多,然后再输注回体内。它们比从捐献者移植的细胞更安全,因为排斥风险消失了。
2009年开始的首次人体试验,旨在测试缺少CCR5受体的基因工程细胞,规模虽小但令人印象深刻。在Quest临床研究中心,拉莱扎里招募了九名接受鸡尾酒疗法、CD4计数持续偏低且艾滋病病毒感染史达20年或更长时间的男性。基因工程细胞在输注后存活下来,他报告的六名患者中,有五名(包括马特·夏普)的CD4计数上升。“两种免疫细胞(CD4和CD8)的比例——在艾滋病病毒感染者中常常异常逆转——恢复正常,而且艾滋病病毒抵抗性细胞甚至迁移到了肠道粘膜,那里是病毒的重要作用部位,”拉莱扎里说。“结果比我可能希望的还要好。”尽管他的方法与蒂莫西·布朗那样的捐赠者干细胞移植(其中整个免疫系统被替换)明显不同,但这是一个充满希望的开端,具有潜在的显著临床益处和更低的风险。
病理学家卡尔·朱恩(Carl June)和内科医生巴勃罗·特巴斯(Pablo Tebas)于2009年在宾夕法尼亚大学发起的一项类似试验也显示出同等的希望。在这项试验中,六名患者在输注经改造的CD4细胞后暂停联合抗逆转录病毒疗法12周,以便科学家能够监测病毒载量以及改造后的免疫细胞在活跃艾滋病病毒存在下的存活和增殖能力。目前,其中两名患者已得到充分研究。一名患者的病毒反弹用了10周,而不是通常的2到4周。另一名患者的病毒在12周后仍无法检测到。下一步是增加基因工程细胞的百分比,可以通过增加输注细胞量、进行多次输注,或者在输注开始前通过化疗降低体内未经治疗的CD4细胞数量。其他研究人员计划将这种方法应用于最近诊断出艾滋病病毒且尚未接受抗逆转录病毒疗法的患者。“这听起来像科幻小说,我知道,就像我刚告诉你人们从火星降落一样,”特巴斯说。“技术已经发展到这种程度。”
这种治疗最可行的方式可能是靶向产生CD4细胞和其余免疫系统的祖细胞——即干细胞本身。如果能够从艾滋病患者身上取出其中一些细胞,对其进行基因改造以使其具有抵抗力,然后将其返回患者体内,它们可能会产生一个完全抵抗该疾病的免疫系统。病毒实际上可能有所帮助,因为它会继续感染和杀死未改变的脆弱细胞——在此过程中摧毁自身的资源。
病毒学家保拉·坎农(Paula Cannon)在小鼠身上已经成功进行了这种干细胞移植,她是南加州大学的病毒学家。坎农使用了一种特殊品系的小鼠,这些小鼠缺乏功能性免疫系统,因此可以接受人类免疫细胞而不会产生排斥反应。小鼠被注入了人类干细胞,其中一半经过基因工程改造,使其CCR5受体消失。8到12周后,经过改造的细胞数量增加,有效地抵抗了艾滋病病毒的感染并控制了其复制。
“这些小鼠是艾滋病病毒研究的真正突破,”坎农说。“但现在我们需要找到最佳点,那个‘金发姑娘’点,在那里我们可以改变足够的干细胞,让人们能够与艾滋病病毒共存。”
最终,抗艾滋病干细胞移植可能看起来是这样的:你的干细胞会被提取出来,并进行基因改造以抵抗艾滋病病毒。同时,你将接受轻度化疗,以清除一些剩余的脆弱干细胞。然后,你将接受新干细胞的注射。它们会迅速增殖,并创建一个具有抵抗力的免疫系统。这个免疫系统,尤其是CD4 T细胞,将具有优势,因为艾滋病病毒永远无法入侵或杀死它们,随着时间的推移,它们将占据主导地位。
一些研究人员乐观地认为,干细胞疗法可能能够实现研究人员所称的功能性治愈:患者将达到缓解状态,其中病毒载量低于每毫升血液50个艾滋病病毒拷贝,标准检测无法检测到,并且他们将不再需要药物。“这种疗法不是要从体内清除最后一个艾滋病病毒。它是关于为身体提供工具,以便在病毒库苏醒时保持健康,”坎农说。“如果人们能够接受这种治疗,不必服用艾滋病药物,病毒水平无法检测到,并且拥有一个功能齐全、健康的免疫系统,这难道还不够好吗?”
对于北卡罗来纳大学教堂山分校的艾滋病研究员戴维·马戈利斯来说,这还不够。他说,当病毒潜伏在体内的潜伏库中时,会对患者的健康造成影响。“你不能这样治愈艾滋病病毒。这是一个巨大的技术难题,就像发明曲速引擎去其他星球一样困难。除非你进入并杀死所有产生CCR5的干细胞,否则总会有病毒可以生长的细胞。你可能会降低病毒载量,你甚至可能阻止疾病进展并消除对抗逆转录病毒药物的需求,但你仍然会有慢性免疫激活以及由此引起的问题。”
为了最终治愈,医生可能需要清除艾滋病病毒在潜伏库中的病毒,将其根除,使其永远不会复发并再次造成损害。马戈利斯及其合作者希望通过“灭菌治愈”来实现这一目标,这种治愈方法能促使艾滋病病毒在其藏身之处开始复制;当病毒积极分裂时,抗逆转录病毒药物就能进入并发挥作用。
最初诱使艾滋病病毒“出洞”的尝试并不顺利。上世纪90年代中期在荷兰进行的一项早期试验,使用炎症抗体来刺激患者的免疫系统,希望能激活艾滋病病毒潜藏的休眠CD4细胞。这些抗体确实激活了CD4细胞,但最终也杀死了它们,耗尽了人体对抗艾滋病病毒的最佳武器。“早期研究惨遭失败,并产生了毒副作用,”加州大学旧金山分校(UCSF)病毒学家华纳·格林(Warner Greene)说。“最终,我们需要找到能激活病毒而不激活T细胞或其他病毒的分子,这不是一项简单任务。”
一些分子已经显示出希望。例如,一种名为组蛋白去乙酰化酶(HDAC)的酶能使艾滋病病毒处于关闭状态,这是病毒隐藏在T细胞中以逃避免疫防御的关键策略。但在2000年,马戈利斯和他的团队发现,他们可以使用HDAC抑制剂——已获批用于稳定情绪和预防癫痫的药物——来逆转这种效应并引出病毒。首先,该团队尝试了一种常见且相对较弱的HDAC抑制剂——丙戊酸,以激活潜伏的艾滋病病毒。“它不是最好的药物,也不是最特异或最有效的,但它已经在临床中使用,人们每天都在服用,”马戈利斯说,他于2005年在《柳叶刀》杂志上发表了他的初步结果。它在一定程度上起作用,在约一半的患者中,在不激活T细胞的情况下降低了潜伏艾滋病病毒载量,尽管即使在该组中,效果也随着时间的推移而趋于平稳或减弱。他现在正专注于一种更强效的HDAC抑制剂,一种相对未经测试的药物——伏诺司他,目前用于治疗几种罕见的癌症。最后,一种名为白细胞介素-7的免疫分子似乎能将病毒从CD4细胞中冲洗出来。研究表明它在接受抗逆转录病毒疗法的艾滋病病毒阳性患者中耐受性良好,并且正在进行几项临床试验。
问题是:完善这种治疗可能需要一种复杂且可能危险的新药物鸡尾酒疗法。HDAC抑制剂除了激活艾滋病病毒外,还可能激活其他病毒,从而引发一场内源性瘟疫。或者,它们可能通过改变细胞将遗传指令从DNA传递到细胞蛋白质的方式来增加患癌症的风险。“这些方法是单独起作用还是需要额外的联合疗法,我们希望能在未来几年内回答这个问题,”马戈利斯说。“这不会是一次性、零和博弈。”
一旦我们了解了一组被称为“精英抑制者”的特殊患者,这些患者占艾滋病病毒阳性成年人的三百分之一,他们拥有超强的免疫系统,能够追踪并杀死艾滋病病毒,那么这些难题就应该迎刃而解。蒂莫西·雷·布朗和其他缺少CCR5受体的人之所以能够战胜艾滋病病毒,是因为他们的细胞不允许病毒进入。精英抑制者之所以保持健康,是因为他们能击溃病毒并将其控制住。
1992年6月,洛琳·威伦伯格(Loreen Willenberg),当时38岁,是一名景观设计师,她梦见自己感染了艾滋病病毒。“我怀疑我的前未婚夫有高危行为,所以我去做了检测,”她解释说。那次检测结果模棱两可;梦境仍困扰着她,两周后她再次检测。“这次我呈阳性,”她说。
当年九月,威伦伯格看了一位艾滋病专家,她的CD4计数高得惊人——超过1800。“我的医生说,‘听着,这非常不寻常,我们继续观察你吧。’三年后,她的病毒载量检测不到,CD4计数很高,医生说,‘洛琳,我想你是国家卫生研究院正在研究的一个特殊群体的一员。他们被感染了,并且持续感染,但他们没有生病。’”被诊断出二十年后,威伦伯格仍然健康,并参与了几项旨在解开她身体为何能够战胜艾滋病的长期研究。
起初科学家们猜测,像威伦伯格这样的患者感染的是艾滋病病毒的弱化版本。约翰霍普金斯医学院的乔尔·布兰克森(Joel Blankson)却发现了相反的情况。“他们携带的是完全致病的病毒,”他说,并引用了他对一对感染相同艾滋病病毒株的单配偶夫妇的研究。丈夫是一名吸毒者,20年前感染了病毒。七年后,妻子被诊断出感染。他说:“他正在接受三重抗逆转录病毒疗法,而她是一名精英抑制者,从未生病。”
直到现在,科学家才开始理解使这一切成为可能生化的机制。一个因素是:我们细胞中被称为人类白细胞抗原(HLA)的监视蛋白的差异。这些分子通过将细胞内部分解的蛋白质(肽)输送到细胞表面发挥作用,在那里其他免疫细胞检查它们,看它们是否是入侵者。HLA有数百种形式,但精英抑制者倾向于拥有两种特定的类型,HLA-B*27和HLA-B*57。去年由Ragon研究所(旨在促进麻省总医院、哈佛大学和麻省理工学院疫苗研究人员之间的合作而成立)发表的一项研究表明,这些抗原可能有助于训练CD8免疫细胞,使其对艾滋病病毒以及丙型肝炎更有效。所有CD8免疫细胞——就像携带艾滋病病毒的CD4细胞一样——在胸腺(一个专门产生T细胞的器官)中成熟,然后才能在体内发挥积极作用;在那里,HLA使CD8细胞接触各种肽,包括人类肽和外来肽。一些HLA——特别是HLA-B*57——倾向于结合更高比例的外来颗粒;更多的HLA-B*57意味着CD8细胞将接触更广泛的外来肽,从而提高它们识别和消灭入侵者(包括艾滋病病毒)的能力。
然而,据该研究的作者之一布鲁斯·沃克(Bruce Walker)称,独特的HLA模式并不能解释所有问题。沃克的同事们对1110名精英抑制者和620名艾滋病病毒感染对照者的基因进行了检测。他们发现,虽然精英抑制者通常拥有编码HLA-B的稀有基因组合,但这些基因“既非控制病毒的必要条件,也非充分条件”。换句话说,一些精英抑制者缺乏HLA-B基因,而一些非抑制者却拥有它们。因此,研究仍在继续。例如,最近该团队发现了一组精英抑制者,他们的p21水平升高,p21是一种抗癌蛋白,在实验室中能破坏艾滋病病毒生命周期的关键方面。
尽管现在全面了解所有相关因素还为时过早,但精英抑制者应该能帮助我们完善治愈方案,彻底根除艾滋病。二十年前,研究人员曾设想疫苗能终结艾滋病。他们的方案被证明不可行,但现在这个目标已触手可及。“这是令人惊叹的一年,”加州大学旧金山分校艾滋病研究中心传播总监、艾滋病政策项目董事会成员杰夫·希伊(Jeff Sheehy)说,他本人也感染了艾滋病病毒。“我在第一批艾滋病病例被记录前大约一年出柜。我度过了一个短暂而辉煌的时刻,然后世界崩塌了,这定义了我的一生。现在我们正在谈论治愈。”
为什么有些人对艾滋病免疫
大约1%的白种人CD4 T细胞(通常能杀死入侵者但却携带艾滋病病毒的白细胞)表面缺乏一种名为CCR5的蛋白质。CCR5是病毒进入的分子通道。由于艾滋病病毒依赖CCR5进入CD4细胞,因此拥有该受体的人容易患上艾滋病。那些没有CCR5通道的人通常不会将艾滋病病毒带入其CD4细胞,并对艾滋病具有天然抵抗力。基因疗法可以将这种抵抗力赋予其他人。
艾滋病病毒阴性者的药物
去年七月,在罗马举行的第六届国际艾滋病学会艾滋病病毒会议上,北卡罗来纳大学免疫学家迈伦·科恩(Myron Cohen)听到科学家和临床医生观众雷鸣般的掌声时,他感到惊讶。他刚刚公布了一项里程碑式试验的结果,该试验涉及来自九个国家的1763对异性恋夫妇,其中一方感染了艾滋病病毒,另一方未感染。科恩发现,早期使用抗逆转录病毒疗法治疗艾滋病病毒,可将病毒传播风险降低96%。换句话说,现在用于治疗艾滋病的药物也可以预防其传播,如果足够多的人及早开始治疗,就能结束这场流行病。
这项研究将夫妇随机分为两组。其中一组,受感染的伴侣立即开始药物治疗。在另一组中,受感染的伴侣推迟治疗,直到他们的CD4 T细胞(病毒攻击的免疫细胞)降至250以下的危险水平,或者直到他们出现艾滋病相关疾病。两组夫妇都接受艾滋病初级护理、咨询和安全套。宣布初步发现后,科恩和他的同事们向所有研究参与者提供了治疗,并将继续监测他们,以观察效果随时间的变化。他们还计划对男男性行为者进行第二次研究。
在肯尼亚和乌干达进行的一项相关研究中,华盛顿大学的科学家报告称,当非感染伴侣而非感染伴侣接受治疗时,传播率显著降低。服用替诺福韦的未感染伴侣,艾滋病病毒感染率下降了62%;那些服用替诺福韦和另一种药物特鲁瓦达(Truvada)组合的伴侣,感染率下降了73%。随着疾病控制中心制定允许未感染者服用特鲁瓦达的指南,艾滋病预防时代即将开启。
吉尔·内马克(JILL NEIMARK) 是一名科学记者和作家。她的青少年奇幻冒险小说,
秘密螺旋,于七月出版。她是《发现》杂志的特约编辑。