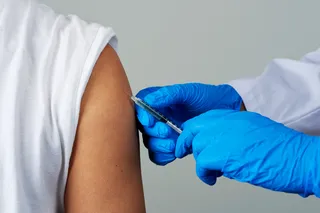
1987年春天,时任美国陆军少校和传染病专家的里普利·巴鲁(Ripley Ballou)妄想自己已经战胜了疟疾。巴鲁是美国国家卫生研究院和沃尔特·里德陆军研究所(简称WRAIR)一个研究团队的成员,该团队开发了一种针对恶性疟原虫(导致最恶性疟疾的寄生虫)的疫苗。“当时的感觉是,”巴鲁说,“这将会轻而易举。”他的队友史蒂夫·霍夫曼(Steve Hoffman),一名海军指挥官,也有同样的妄想,纽约大学的该领域资深学者鲁思·努森茨威格(Ruth Nussenzweig)和维克多·努森茨威格(Victor Nussenzweig)也一样,他们开发了一种竞争性疫苗。
四人中,努森茨威格夫妇是幸运的。尽管他们的发现直接促成了这两种疫苗的开发,但当时他们都已年近六旬,超过了自我测试纽约大学疫苗的年龄限制。然而,巴鲁和霍夫曼当时都三十多岁,看起来就像一部电视医疗剧的主角,或者《陆军野战医院》的续集。包括霍夫曼和巴鲁在内的十五名志愿者接种了疫苗。然后,霍夫曼、巴鲁和另外四名志愿者被感染疟疾的蚊子反复叮咬。(另外两名未接种疫苗的志愿者也允许感染疟疾的蚊子叮咬他们,以便为研究人员提供比较依据。)用疫苗学的话说,志愿者们受到了疟疾的“挑战”。他们将定期接受疟原虫检测,一旦任何人的血液中出现寄生虫,当然会立即用抗疟疾药物治疗。
几周过去了,这是疟原虫在人体内繁殖所需的时间。六名接种疫苗的志愿者中有三人病倒了。但巴鲁和霍夫曼没有,他们相信自己受到了保护。这是一种令人兴奋的感觉。霍夫曼飞往圣地亚哥,他将在那里的一次会议上发表演讲,而巴鲁跑了六英里,之后参加了一个派对。喝了一杯啤酒后,巴鲁开始出汗、发烧,正如他所描述的,“陷入了麻烦”。
“我先是发冷,然后高烧——体温高达104度——头痛欲裂。我从未生过这么重的病,”他说。“第二天早上我去了医院,果然,我的血液里有寄生虫。他们给我服用了抗疟疾药物,但我仍然病了一天半。在那之后,我足足六周才真正康复。在圣地亚哥,霍夫曼也在经历着一场公开的同样痛苦。”“我正在做演讲,霍夫曼说,然后我就出现了疟疾特有的寒战。就是这样。”
霍夫曼和巴鲁痛苦地重新学习了与疟原虫斗争的首要教训。正如巴鲁所说:“疟疾是一种可怕的疾病。很难预防。”
根据世界卫生组织的统计,疟疾每年导致约270万人死亡,其中大部分是五岁以下的儿童。它还感染了3亿到5亿其他人,其中90%以上在非洲,其余主要分布在南亚和东南亚以及中美洲和南美洲。这种蚊媒寄生虫可能杀死了地球上有史以来一半的人类。更糟糕的是,经过多年适度缓解后,这种疾病正在卷土重来。携带它的蚊子已经对杀虫剂产生了抗药性,寄生虫本身也对抗疟疾药物产生了抗药性。世界银行正在讨论发起一项为期30年的努力来遏制这种不断上升的寄生虫潮,而美国国立卫生研究院和世界卫生组织也在合作解决这个问题。然而,并非所有消息都令人沮丧。包括巴鲁和霍夫曼在内的疫苗学家再次允许自己抱有一丝乐观。
回想起来,1987年那些痛苦的试验可能是抗击疟疾的转折点。从中吸取的教训和采用的技术已经促成了一些有前景的疫苗。1997年1月,由巴鲁领导的沃尔特·里德陆军研究所研究人员与比利时葛兰素史克生物制品公司合作,发表了一项研究结果,其中一种疫苗保护了七名志愿者中的六名。沃尔特·里德陆军研究所和努森茨威格夫妇去年秋天都开始测试新疫苗,而霍夫曼和他在海军医学研究所的同事们已经开始对一种称为DNA疫苗的全新技术进行临床试验。美国国立卫生研究院的研究人员甚至正在研制一种“良性”疫苗,它实际上不会阻止个体患上疟疾,但会抑制其将寄生虫传回蚊子。如果成功,它应该能防止小型疟疾爆发演变成流行病。
然而,尽管有这些令人鼓舞的消息,仍有几点重要的限制值得立即提及。首先,即使这些疫苗奏效,它们中的任何一种也不可能在至少十年内普及到普通民众。其次,研究人员已经学会降低他们对“战胜疟疾”的标准。“我们谈论的不是脊髓灰质炎疫苗那种,接种后就永远不会得病,”帮助美国国立卫生研究院运营疟疾研究项目的昆虫学家鲍勃·格瓦兹(Bob Gwadz)解释说,“我们可能谈论的是能够消除死亡率并显著降低与该疾病相关的发病水平的疫苗。”
寄生虫的恶性是疫苗问题的核心。恶性疟原虫比病毒甚至细菌都要复杂得多。病毒只不过是一小段核酸(RNA或DNA),包裹在蛋白质外壳中。为了复制自身,它必须渗透你的细胞并利用它们的机制。细菌,如沙门氏菌,是一个简单的单细胞生物。疟疾寄生虫也是单细胞的,但与细菌不同,它在其生命周期中会呈现多种形式,巧妙地逃避身体的防御。经过与人类免疫系统长达百万年的进化斗争,它已经进化出繁衍的方式,使其看起来几乎是蓄意恶意的。“这些寄生虫具有非凡的能力来逃避我们的免疫系统,”格瓦兹说,“而且它们已经这样做了很长时间。每当人类免疫系统找到一种方法来对抗寄生虫时,寄生虫就会找到一种方法来规避免疫系统。”
疟原虫的生命周期在蚊子、人类之间循环往复(或者,取决于你的观点,在人类、蚊子之间循环往复)。为了讨论方便,我们从蚊子在吸血时通过唾液将疟疾寄生虫注入你的皮肤开始。在这个阶段,寄生虫呈子孢子形态。它们进入你的血液,并在那里停留半小时,然后钻入你的肝细胞,在那里潜伏一周左右,疯狂繁殖。当它们再次出现时,在爆发时摧毁细胞,寄生虫不再是子孢子,而是一种更圆、更紧凑的形态,称为裂殖子。现在,每有一个子孢子,就有数万个裂殖子。
裂殖子在你的血液中漂浮几秒钟后,便会入侵并定殖你的红细胞。安稳地寄居后,裂殖子会繁殖48小时,数量增加二十倍,然后爆发出来入侵新的红细胞。然而,有时它们会在红细胞内形成新的形态,称为配子体。这是有性阶段,也是寄生虫唯一以雄性和雌性形式存在的时期。经过几次进出红细胞的循环后,数百万甚至数十亿的寄生虫很可能已经在你的血液中安家。此时,任何叮咬你的未感染蚊子都会吸食红细胞。配子体只有在温度下降使它们相信自己身处蚊子相对寒冷的肠道中时,才会从受感染的红细胞中出来。现在被称为配子/合子,它们会繁殖并产生卵囊——可以想象成囊肿和卵囊的结合体。从卵囊中会孵化出子孢子,这就是我们开始的阶段。子孢子在蚊子体内发育需要两周时间,通过其肠道进入血液,最终感染其唾液腺。现在它们可以被回注到人体中,整个循环又重新开始了。
疟原虫以惊人的效率适应了人类宿主。你可以把你的免疫系统想象成有两层防御:抗体,它识别血液中的外来入侵者并标记它们供其他免疫细胞攻击;以及细胞防御,例如杀伤性T细胞,一旦入侵者进入你的细胞,它们就会追踪并杀死你自己的细胞。疟疾这两种防御都能避开。
首先,蚊子注入寄生虫后,它们在你的血液中只停留半小时,然后就躲藏在肝细胞中。因此,它们易受抗体防御系统攻击的时间只有那么短——这通常不足以让抗体杀死所有寄生虫。一旦它们在你的肝细胞中定植,你的杀伤性T细胞就会开始工作,但这需要时间。美国国立卫生研究院研究医生戴维·卡斯洛(David Kaslow)说:“免疫系统可能需要10到12天的时间才能产生这种反应来杀死受感染的细胞。那么寄生虫会怎么做呢?它就在这种反应即将启动的时候跳出肝细胞,跳入红细胞。红细胞不受这种特定的T细胞反应的影响。如果你是寄生虫,你想选择身体中最丰富且没有反应的细胞类型,你会直接选择红细胞。”但寄生虫还没有完全保护自己免受你的免疫防御。当它们在红细胞内发育时,它们会在细胞表面挤出微小的结节。这些结节会导致受感染的红细胞粘附在你的毛细血管以及你大脑和其他器官的非常小的血管壁上。这些结节起到了保护作用:使受感染的红细胞远离你的脾脏,否则它们会被识别为坏血并从系统中清除。粘附在血管壁上,受感染的细胞永远不会被脾脏清除。卡斯洛说:“聪明吗?嗯,寄生虫不聪明,但进化是聪明的。”这种疾病的临床症状只出现在寄生虫处于红细胞阶段时。受感染的红细胞堵塞你的小血管,导致氧气流向组织减少。当血细胞破裂释放裂殖子时,它们会进一步削弱你身体输送氧气的能力。恶性疟原虫可以感染高达70%的血细胞。当这些细胞破裂时,你就会失去70%的输氧能力。直接结果是贫血,随后是脑型疟疾,因为你的大脑开始遭受严重缺氧的影响。
疟疾感染并非永久性的。恶性疟疾是最严重的疟疾类型,如果不加以治疗,它会杀死多达一半的感染者。那些不死且未接受抗疟疾治疗的人最终会在三到五年内摆脱这种疾病。问题是,如果他们居住在疟疾流行区,他们很可能会再次感染,而20亿人——世界人口的三分之一——生活在疟疾流行区。格瓦兹说,在非洲,三分之一的死亡是由重症疟疾引起的,三分之一是由慢性贫血引起的。在某些人身上,寄生虫数量如此之高,你会患上脑型疟疾并死亡。在另一些人身上,它时高时低,持续存在,但每48小时就会破坏红细胞。所以你患有慢性贫血。慢性贫血会给你带来什么后果?它基本上会降低你对其他所有疾病的抵抗力,你可能会死于麻疹或普通感冒。三分之一的死亡是由胎儿氧气和营养供应不足引起的——低出生体重婴儿、死胎和流产。
尽管疟疾寄生虫在人类漫长的历史中造成了巨大的破坏,人类免疫系统仍然进化出防御致病原的能力,而且在大多数情况下,它做得非常出色。然而,它必须足够快地阻止不可逆转的攻击,有时当它发动反击时,病毒、细菌或寄生虫已经永久性或致命地潜伏在你的体内。
为了应对真实的威胁,疫苗通过刺激免疫系统对明显的威胁产生抗体来发挥作用。当真实的威胁来临时,免疫反应会大大加速;防御系统会足够迅速地动员起来,在感染源造成虚弱或致命的长期影响之前将其清除。
最有效的疫苗依赖于减毒的,或者简单地说,是真实病原体的灭活版本来刺激免疫系统。这些疫苗会诱导免疫反应,同时又缺乏导致实际疾病的因素。经典的例子是1796年爱德华·詹纳使用牛痘——一种与天花相关的疾病,在牛身上引起严重疾病但在人类身上不会——来接种疫苗以预防其致命的人类近亲。如果你在前往热带地区之前接种黄热病疫苗,你将得到一种被无害化的活病毒,尽管它仍然能够诱导对真实病原体的免疫反应。一剂黄热病疫苗可以保护你至少十年。
然而,疟疾给试图研制疫苗的免疫学家带来了一系列独特的问题。最主要的是,我们能战胜的病毒或细菌不会在我们体内变态;它们不会像疟疾寄生虫那样呈现令人困惑的多种阶段。疟疾在人体内有四个阶段。针对子孢子的疫苗不一定会针对肝脏阶段、血液阶段或配子体,同样,针对后期阶段的疫苗也不一定会阻止子孢子。如果你的子孢子疫苗促使抗体反应杀死了蚊子注入你血液中99%的子孢子,那仍然可能有一个存活下来并在你的肝脏中产生3万个裂殖子。如果你制造一种疫苗能诱导杀伤性T细胞攻击肝细胞中的寄生虫,但它们漏掉了一两个,你仍然会有成千上万的裂殖子在血液中横冲直撞。当你研制疟疾疫苗时,99.9%的效率似乎不能使人摆脱疾病。“这是一种复杂的多阶段生物,”霍夫曼简单地说,“我们没有针对复杂多阶段生物的疫苗。我们正在尝试做以前从未做过的事情。”
一种可能的解决方案是制造一种减毒寄生虫疫苗,但这也有其自身的困难。首先,研究人员无法在实验室中培养这种寄生虫。或者更准确地说,他们可以培养红细胞寄生虫,但是,巴鲁说,“你的寄生虫在红细胞内部。你如何大规模生产红细胞?这办不到。”与此同时,子孢子只能在蚊子体内生长,而寄生虫的肝脏阶段只能在人类肝细胞中生长,世界上只有少数几个实验室能够培养这些细胞,而且数量很少。
这并非说无法研制出成功的疟疾疫苗。30年来,我们已经知道,如果你用射线照射感染了子孢子的蚊子(和其中的子孢子),蚊子体内的寄生虫就会被适当地减毒,就像减毒的黄热病病毒一样。然后你可以让蚊子将它们注入你的血液,将它们添加到你身体的天然动植物群中。这些经过辐射的寄生虫会进入你的肝脏,但它们不会成熟、产生裂殖子并定殖你的红细胞。子孢子只会留在你的肝脏中,除了对你的免疫系统产生令人印象深刻的反应外,什么也不做。现在,如果一只误入歧途的蚊子将健康的疟疾寄生虫注入你的血液,你的身体就会将其杀死,至少在接下来的几个月里是这样。
在20世纪40年代,研究人员证明,经辐照的子孢子可以保护对某种禽类疟疾易感的鸡。1968年,纽约大学的鲁思·努森茨威格(Ruth Nussenzweig)和杰罗姆·范德伯格(Jerome Vanderberg)表明,这种疫苗接种方法对小鼠和猴子有效,几年后他们和其他人又证明它对人类也有效。但是,尽管该领域的一些研究人员已经开始用经辐照的子孢子给自己接种疫苗——例如霍夫曼——但归根结底,对于野外数十亿暴露于这种疾病的人来说,这根本不切实际。可能需要被辐照蚊子叮咬一千次才能诱导免疫力,而且,正如霍夫曼所说,“你不能让数十亿人被数千只受感染的蚊子叮咬。这不划算。”
然而,正是这些经过辐射的子孢子,掌握了自那以来取得的大部分进展的关键。正如鲁思·努森茨威格所描述的,当研究人员将子孢子放入被辐射蚊子叮咬过的人的血清中——这意味着他或她现在拥有了抗疟疾的抗体——并用电子显微镜检查子孢子时,他们可以看到每个子孢子都覆盖着一层厚厚的包膜,尾部拖着一条大约是寄生虫本身五倍长的尾巴。维克多·努森茨威格将其描述为“看起来像蛇蜕皮”。霍夫曼说,“基本上,表面包膜脱落了,你一看,就会想,‘嘿,那个子孢子可能不再有活力了。’”显而易见的含义是,这种反应是抗体攻击的结果。维克多说,希望是,“如果你识别出引起这种反应的分子,它就可以用作疫苗。”
他们花了一段时间,但到1979年,努森茨威格夫妇和他们的合作者已经确定了抗体的靶点是一种构成子孢子保护性包膜的蛋白质;他们称之为环子孢子蛋白(或CS蛋白)。他们只待分子生物学技术赶上,便在实验室中合成了该蛋白质的重要片段,将其注射到小鼠体内,观察小鼠产生针对它们的抗体,并观察这些抗体在活子孢子引入后对其进行攻击。这些抗体不仅能抵抗疟疾,而且效果惊人。没有一个子孢子存活下来并定殖小鼠的肝细胞。
这导致了1987年的试验及其狂热的结局。多亏了努森茨威格夫妇的工作,疟疾研究人员可以有效地攻击寄生虫。接下来,纽约大学的一个研究团队和美国国立卫生研究院与沃尔特·里德陆军研究所的一个研究团队克隆了编码CS蛋白的基因。这时,巴鲁和霍夫曼作为由沃尔特·里德陆军研究所的韦恩·霍克迈尔和美国国立卫生研究院的卢·米勒领导的团队的初级成员参与进来。
巴鲁说:“美国国立卫生研究院有这项提取基因的技术。沃尔特·里德陆军研究所有这项识别我们何时拥有基因的技术。我们把两者结合起来,一个月内就克隆出了那个该死的东西。”美国国立卫生研究院/沃尔特·里德陆军研究所团队随后寻找一家制药公司来帮助开发疫苗,并找到了史克公司,一家最大的公司。努森茨威格夫妇和他们在纽约大学的合作者找到了罗氏公司,也是最大的公司之一,竞争开始了。美国国立卫生研究院/沃尔特·里德陆军研究所团队将他们的基因放入细菌中,让细菌产生CS蛋白的拷贝,然后将其注射到小鼠体内,最终注射到包括巴鲁和霍夫曼在内的六名人类志愿者体内。努森茨威格夫妇和他们的同事菲德尔·萨瓦拉使用了所谓的合成蛋白质,这意味着他们在实验室中逐个构建了蛋白质的关键部分。然后,他们在马里兰大学的合作者向三名人类志愿者注射了大剂量的疫苗,其中没有一个是努森茨威格夫妇。
然后,维克多·努森茨威格说,有了大规模宣传,这根本无法控制。它制造了一种虚假的乐观前景,事后看来,这真的是致命的。
然而,这些试验并非一无是处。在美国国立卫生研究院/沃尔特·里德陆军研究所研究人员免疫的六名志愿者中,有一人未患疟疾。而在另外五名患病者中,霍夫曼和巴鲁的病情进展比未接种疫苗的情况下要慢。“疫苗正在发挥作用,”巴鲁说。至于努森茨威格夫妇,在他们免疫的三名志愿者中,有一人未患疟疾,另外两人仅在延迟后才进入血液阶段,因为他们的大部分子孢子已被清除。“试验既失败了也未失败,”维克多说,“我们不认为[试验]是失败的,因为它证明了通过CS蛋白疫苗接种预防疟疾感染是可能的。其他人认为它失败了是因为他们的期望不合理。他们期望,”鲁思说,“一针、一枚免疫子弹就能预防疟疾。从来没有这样开发过疫苗。”
从1987年第一支CS蛋白疫苗到去年报道的WRAIR成功,在这十年间,研究人员从保护六名志愿者中的一人发展到七名中的六人,但他们为此进行了二十次临床试验。他们的核心方法是巴鲁所说的“分子生物学技巧”,以使CS蛋白能诱导免疫系统产生最大的反应。这些技巧包括将CS蛋白的片段与称为佐剂的化学添加剂结合使用。
他们还研究了在人体中表达该蛋白质的不同方法——例如,通过克隆一个基因,该基因将与乙肝病毒的一个片段结合产生该蛋白质。结果是一种像颗粒而不是长链一样聚结的蛋白质。巴鲁说:“颗粒更像真正的病毒,这意味着免疫系统会采取更积极的方法进行反击。”
到目前为止,结果是七分之六的数字,这令人印象深刻,尽管其印象深刻的程度尚不清楚,因为保护期尚不明确。无论出于何种原因,免疫系统似乎并不擅长记住它曾拥有疟疾抗体。“我们取得了巨大的进步,”巴鲁说,“我们学到的信息是,我们必须付出非凡的努力才能获得那种免疫反应,但这是可以做到的。”
现在,巴鲁和他在沃尔特·里德陆军研究所的同事们已经开始测试他们疫苗的另一个变体,希望能增加保护作用,而努森茨威格夫妇正在准备测试三种新疫苗。他们的同事伊丽莎白·纳丁(Elizabeth Nardin)在过去几年里一直在识别CS蛋白中更多能在人体中引发免疫反应的片段,她已经使用这些片段的合成版本制造了疫苗,鲁思说,这些疫苗“至少在小鼠体内产生了天文数字般的抗体”。此外,CS蛋白的这些片段似乎能引发多种免疫反应。免疫系统充满了防御系统,包括杀伤性T细胞和帮助激发免疫系统的γ干扰素等分子。寄生虫的这些片段似乎能刺激许多不同的反应。努森茨威格夫妇很乐观,但他们也知道,在应对疟疾时,乐观可能是一种妄想。
无论这些疫苗会发生什么,该领域很少有人相信他们可以通过仅仅针对子孢子来战胜疟原虫。这就是为什么这些研究人员,尽管仍然充满了竞争,但谈论疫苗的追求是一种团队合作,最终产品很可能是一种针对寄生虫生命周期不同阶段的多种疫苗混合物。
例如,霍夫曼在过去五年里一直与他的同事们研究一种疫苗,这种疫苗将在寄生虫在肝脏中繁殖时对其进行攻击。他们已经成功识别出这些肝脏阶段在从子孢子转变为裂殖子时表达的六个基因,去年夏天他们开始测试一种新型DNA疫苗的安全性。其想法是将CS蛋白基因注入肌肉,肌肉会吸收该基因并开始产生寄生虫在肝脏中产生的相同蛋白质。如果一切顺利,你的免疫系统就会将该蛋白质识别为入侵者,并做好充分准备,拥有一支杀伤性T细胞大军。霍夫曼和他的同事们希望到今年夏天能了解该疫苗在人类身上的效果是否与在小鼠身上一样好。
在英国,伦敦国家医学研究所的托尼·霍尔德一直在研究血液阶段的寄生虫,即裂殖子。早在1981年,霍尔德和他的同事们就识别出裂殖子表面的一种蛋白质,这种蛋白质似乎是分解红细胞壁并成功进入红细胞的重要工具。霍尔德和他的同事们用这种蛋白质免疫了小鼠,小鼠产生了正确的抗体,当小鼠随后被注射感染的血液时,抗体直接攻击了这种蛋白质,裂殖子发现自己被锁在红细胞之外。
霍尔德解释说:“如果它们无法进入红细胞,循环就会中断。如果我们可以完全中断这个循环,我们不仅可以预防临床疾病,而且在很大程度上可以阻止传播给下一个人,因为血液阶段形成了性阶段,然后传播给蚊子。”三年前,霍尔德展示了用血液阶段蛋白质的一部分免疫啮齿动物就能完全阻止疟疾。“太棒了,”他说,“你根本看不到任何寄生虫。”现在他和他的同事们一直在努力保护人类,他也感到相当乐观,尽管伴随着与疟疾相关的常见谨慎。在他们证明能够保护人类之前,他们免疫小鼠对抗疟疾的意义仅限于小鼠本身。
然而,对蚊子进行寄生虫免疫不仅可以帮助蚊子,这也就引出了“良性疫苗”。这种疫苗并不能阻止你生病,但能阻止你将疟疾传染给下一只吸食你血液的未感染蚊子。这种疫苗是美国国立卫生研究院大卫·卡斯洛(David Kaslow)的工作成果,他的想法是主动为人类接种疫苗,从而被动地免疫蚊子。他解释说:“所以当蚊子吸血时,除了感染的血液,它还会吸入抗体,这将保护它不被感染。”
卡斯洛的策略是在寄生虫最薄弱的环节发起攻击。虽然受感染的人类血液中含有数十亿裂殖子,但只有极少数会进一步发育成配子体(有性阶段)。他解释说,很明显,蚊子在吸血时不会将人吸干,因此在循环的配子体中,只有一小部分会被蚊子吸收。一只蚊子可能只摄入几千个配子体,其中可能只有十个能在其肠道中存活并产生卵囊,然后卵囊中会孵化出成千上万个子孢子,它们会重新感染人类。卡斯洛说:“所以我们谈论的是阻止几个卵囊的形成,而不是阻止数十亿个寄生虫。”此外,在蚊子的中肠中,寄生虫会释放出从未与人类免疫系统打过交道的蛋白质,因此它们从未进化出规避人类免疫系统的策略。这增加了它们的脆弱性。
卡斯洛说:“我们现在正在做的就是通过对从未受到过免疫选择的东西产生免疫反应来创造一种人为的情况。”他计划用通常只在蚊子中肠中表达的配子/合子蛋白来给人类接种疫苗。接种过疫苗的人会产生抗体,这些抗体会随着血液被蚊子吸入。因此,当配子/合子从蚊子肠道中感染配子体的红细胞中出现时,抗体就会在那里等着它们。
早在1988年,卡斯洛和他的同事们就识别出了一种蛋白质,这种蛋白质只在寄生虫停留在蚊子肠道期间由其基因产生。从那时起,卡斯洛一直在努力将其转化为疫苗。这十年间,一个又一个恼人的问题接踵而至。首先,研究人员必须让他们的蛋白质正确折叠,以便抗体能够识别它。这花了一年时间。然后他们不得不放弃用来生产和递送蛋白质的病毒,因为它可能会伤害许多免疫系统因艾滋病毒而受损的撒哈拉以南非洲人。所以他们花了两年时间从酵母中生产疫苗。卡斯洛说:“看起来很棒,真的很好。”然后他们试图扩大生产规模,但失败了。卡斯洛说:“它降解了。当我们试图从台式实验扩大到大型发酵罐时,出现了各种问题。”到那时,大约在1993年,他们选择的制药公司失去了兴趣,所以他们花了一年时间寻找一家新公司,就这样持续下去。
两年前,卡斯洛和他的同事们终于开始了人体试验。人类对这种蛋白质产生了抗体,但这些抗体并未阻止向蚊子的传播。另一方面,卡斯洛已经表明这种疫苗相对安全,而且他使用的配方并未特别优化以引发良好的免疫反应。所以现在卡斯洛正在开始巴鲁和他的沃尔特·里德陆军研究所同事们已经遵循了十年的常规——调整佐剂和递送系统以获得最佳的免疫反应。他说:“这看起来非常有希望。”
如果它安全,并且在这里的对照环境下能阻断传播,那么他们就会去非洲进行实地试验。这无疑会带来一系列全新的障碍。他说:“你必须为所有有两条腿的人接种疫苗,因为你希望整个人口都接种疫苗。如果你只为成年人接种疫苗,效果不会很好,因为儿童也能传播。然后,一旦我们有了看起来不错的东西,我们就会开始将其与其他保护性疫苗、其他阻断传播的疫苗或其他干预措施结合起来。”
卡斯洛很乐观,几乎每个人在谈论自己的疫苗时都如此。霍夫曼指出,他们必须如此——否则他们就会放弃。但当他们谈论将疫苗带到实地时,研究人员听起来就不那么乐观了。问题是巨大的。每年有两到三百万人死于疟疾。数十亿人面临风险。儿童受到的威胁最大,但为六个月以下的婴儿接种疫苗——这是必须做的——也带来了其独特的挑战。因此,疫苗学家和热带医学专家们坦诚地谈论他们愿意将什么视为胜利。例如,为大部分疫苗测试提供资金的军方,希望开发一种能保护部队对抗寄生虫六个月的疫苗,足以在热带地区作战。这种疫苗也适用于旅行者。对于撒哈拉以南非洲地区的数亿人,研究人员可能会满足于任何能减轻疾病痛苦和死亡负担的措施。例如,一种能让儿童免疫系统像20岁成人一样运作的疫苗,将使儿童活得更久、更健康,因为20岁的成人可以在一场可能杀死儿童的疟疾发作中存活下来。
许多研究人员承认,在他们的噩梦中,他们认为这种寄生虫是无法战胜的。他们担心,即使他们找到了阻止寄生虫的方法,寄生虫也会进化出绕过疫苗的方法。但这只是在他们的噩梦中。“我非常清楚这个问题有多困难,”霍夫曼说,“我意识到短期内成功的几率微乎其微,但我们多年来取得了惊人的进展,我们正在拼凑出最终能通过疫苗预防疟疾的拼图。这是否会是今年、明年,还是10年或15年后,还有待观察。”