在密歇根州立大学一间杂乱的实验室附属房间里,两位昆虫学家正俯身对着一台 25 英寸的电脑显示器,屏幕上闪烁着模糊的触角、弯曲的腿和多面复眼。弗拉基米尔·科科扎身穿白大褂,脸被屏幕的光照亮,他熟练地操作着键盘和鼠标,将昆虫的身体部位聚焦。很快,一只《鬼屋魔怪》尺寸的埃及伊蚊的影像出现了。亚历山大·莱克尔(Alexander Raikhel)倾身凑在科科扎(Kokoza)的肩膀上,指向昆虫的眼睛,由于基因改造,它们的眼睛呈现出明显的深红色。莱克尔苍白的脸上露出了慈父般的笑容。“这些小小的埃及伊蚊是我们制造一系列定制蚊子的又一步。”他说。
吸血的蚊子或许是地球上最持久的祸害,每年将疟疾、登革热、黄热病以及其他多种疾病传播给超过 5 亿人,并导致 200 万至 300 万人死亡。仅在美国,每年就喷洒数十亿加仑的杀虫剂,试图消灭这些微小的害虫。但在莱克尔位于东兰辛的实验室里,蚊子却受到了极大的呵护。它们居住在安全、温控的房间里。它们受到捕食者和疾病的保护。莱克尔的助手科科扎有时还会牺牲自己的肉体来喂养它们,甚至能哄那些虚弱的蚊子吸食他的血液。

这些实验室里的蚊子无微不至,因为莱克尔和科科扎相信它们可以从疾病传播者转变为疾病的抵抗者。通过各种基因改造技术,莱克尔和他实验室的竞争对手们正试图剥夺蚊子传播寄生虫感染的能力。莱克尔的策略是增强蚊子的免疫反应,使其能够杀死它们通常携带并传播给人类的病原体。他实验室中经过改造的埃及伊蚊的红眼睛,是为了标记一个触发了免疫蛋白防御素(defensin)更高产量设计的基因。这种蛋白质能识别并摧毁许多微生物。
几年之内,这些转基因蚊子的后代或近亲可能会成为第一批被刻意释放到自然环境中、由人类制造的动物。莱克尔的最终目标是制造出携带额外防御素或其他类似免疫因子的蚊子,然后让它们与野生的蚊子种群杂交并取代它们,从而阻止疾病传播给人类。“我们可以制造出在野外具有基因优势,但又无法传播疾病的蚊子,”莱克尔说。“至少我们是这么希望的。”
当然,基因改造并非没有风险。最坏的情况下,转基因蚊子可能只是昂贵的无用功。最糟的是,它们可能只在短时间内有效,并且会导致疫情爆发,因为野生蚊子会重新抬头,并开始叮咬那些随着时间推移已经失去抵抗力的个体。莱克尔和其他蚊子制造者越接近成功,怀疑论者就越感到不安。“转基因蚊子会变异,”哈佛大学公共卫生学院的昆虫学家安德鲁·斯皮尔曼(Andrew Spielman)警告说。“具体如何变异,我们不知道。”
近二十年前,昆虫学家和细胞生物学家就开始尝试创造设计师蚊子的想法。“我们对抗蚊子的工具——药物和杀虫剂——大部分可以追溯到二战时期或之后,”圣母大学热带病研究与培训中心(Center for Tropical Disease Research and Training)的昆虫学家弗兰克·H·柯林斯(Frank H. Collins)指出。而且它们正变得越来越无效。例如,引起最致命蚊媒疾病——疟疾——的最危险原虫——恶性疟原虫(Plasmodium falciparum)——已经对许多药物产生了抗药性。
亚历山大·莱克尔(左)在西伯利亚东部长大。他研究蜱传疾病,直到 1979 年移居美国,那时他开始对蚊子产生兴趣。弗拉基米尔·科科扎(右)也在西伯利亚长大。这两位昆虫学家于 1992 年在一次会议上相遇。


更棘手的问题是蚊子的顽固性,它们在地球上比人类出现得早,并且拥有一种适应几乎任何环境的不可思议的能力。一种生活在非洲沙漠的蚊子,会将其携带病菌的卵产在沙子里,在那里它们可以休眠数十年,直到一场异乎寻常的雨水降临。然后它们孵化并飞舞起来,准备感染人类。其他更接近人类的蚊子种类不再只在池塘和沼泽中繁殖;相反,它们会抓住机会产卵。例如,埃及伊蚊会在轮胎、瓶子和锡罐中繁殖。早在 20 世纪 50 年代,科学家们就注意到许多蚊子能够抵抗最有效的杀虫剂 DDT。
然而,蚊子并非生来平等。在 2500 种蚊子中,只有大约 100 种已知会将病原体传播给人。大多数根本不以人类为食,它们更喜欢动物的血液。在那些以人类血液为食的蚊子中,许多在传播之前就会杀死它们获得的病原体。到了 20 世纪 80 年代中期,莱克尔和其他人开始寻找线索,研究这些“无能”的蚊子是如何阻止疾病传播的,以及这种特质如何被转移并成为更危险物种的基因优势。首先,研究人员试图进行最简单的改造——插入一个控制眼部颜色的基因——来证明蚊子是可以被改变的。他们选择了埃及伊蚊,一种传播黄热病和登革热病毒的媒介,因为它容易繁殖。鉴于在另一种流行的实验室昆虫果蝇(Drosophila)上的成功经验,似乎成功的几率很大;几十年来,实验室一直在创造新的常见果蝇模型。出乎意料的是,蚊子制造者遇到了麻烦。“大约有五年时间,我们每次开会都只是谈论我们的失败,”莱克尔说。
加州大学尔湾分校(University of California at Irvine)的遗传学家安东尼·詹姆斯(Anthony James)回忆说:“我们尝试了大约 80 到 90 个实验,涉及数十万只蚊子,但就是无法正确地让它工作。”问题出在科学家们选择了一种转座子(transposable element)或称“跳跃基因”(transposon)。这些小段 DNA 可以插入到生物体的染色体中,基因研究人员利用它们将新基因插入植物和动物。

从蚊子的有机玻璃住所中取出像罂粟籽大小的卵,并在显微镜下小心地注射新的 DNA。
蚊子工程师们使用的是一种名为 P 的转座子,这种转座子在果蝇中已经使用了多年。“事实证明,果蝇有几种宿主因子——蛋白质——促进了 P 的(插入),”詹姆斯说。
20 世纪 90 年代中期,马里兰大学生物技术研究所(University of Maryland Biotechnology Institute)的分子遗传学家大卫·奥布罗奇塔(David O'Brochta)在家蝇中发现了一种新的转座子,并将其命名为赫尔墨斯(Hermes),以希腊信使神命名。其他研究人员随后又发现了三种——mariner、Minos 和 piggyBac。1998 年,詹姆斯跨越了障碍:利用赫尔墨斯将新的遗传物质导入蚊子基因组,成功培育出了一只具有红眼睛的埃及伊蚊。
詹姆斯的成功激发了其他实验室的工作。莱克尔迅速将重点放在提高蚊子产生防御素的能力上。像包括人类在内的许多动物一样,蚊子也会产生防御素来抵御细菌的侵袭;防御素会刺穿细菌的细胞壁,将其摧毁。但更进化的寄生虫,如引起疟疾的原虫,经过亿万年的演化,已经发展出莱克尔称之为“高度精密的系统”,能够逃避蚊子摄入时的检测,并在蚊子体内繁衍而不伤害它们。最终,这些寄生虫会迁移到唾液腺,在那里耐心等待蚊子叮咬人类时,将它们传播给新的宿主,在那里它们可以造成真正的危害。
莱克尔认为,如果他能够改造蚊子,使其在每次吸食血液时都能产生防御素,那么这些寄生虫在到达唾液腺之前就会被杀死。首先,他找到了一个由进食血液触发的基因。然后,他将这个基因与指导防御素产生的基因结合起来。接下来,他需要将这个新的嵌合基因插入埃及伊蚊。莱克尔和他的团队迅速建立了一条流水线,以完成这项艰巨而精细的任务。蚊子在微小的有机玻璃笼子里产下的罂粟籽大小的卵被小心地收集起来,放在显微镜下。技艺娴熟的技术人员用现场制作的超细针头刺穿每个卵壳,并注射新的 DNA——携带嵌合基因的赫尔墨斯转座子和一个标记眼部颜色的基因。然后,卵在盛有温水的浅盘中孵化。幼虫孵化,发育成蛹,最后孵化成成蚊。这些蚊子然后互相交配。当它们的后代孵化时,实验室助理在显微镜下扫描着一盘盘新孵化的昆虫,寻找表明转基因蚊子已经诞生的标志性红眼睛。
“这里的一个小伙子工作非常快,”科科扎说。“他只是把装着数百只孵化蚊子的托盘拿过来,如果没看到红色,他就把它们冷冻起来。”但有一天,在闪亮的翅膀和柔软的身体中,隐藏着一对红眼睛。直到那只生物死后才被发现。“他说:‘没问题。我们再做一个。’,”科科扎沉重地叹了口气。“我们花了大约六个月。”
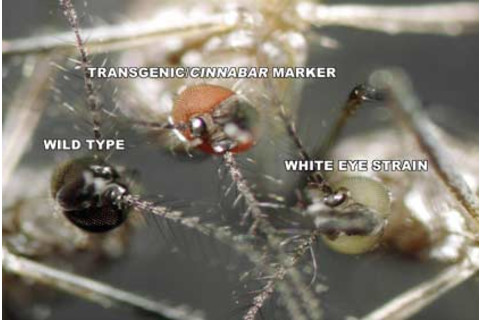
这些埃及伊蚊的眼睛讲述了基因改造的故事。黑眼睛的蚊子(左)是野生且未被触动的。白眼睛的蚊子(右)是一种特殊的实验室品系,向其注入了新的遗传物质。如果新的 DNA 成功,后代的眼睛将显示为红色,如中间的蚊子所示。
一旦红眼睛的蚊子开始大量出现,莱克尔就证实了他制造出了第一只功能性转基因蚊子——这种昆虫不仅外形不同,而且行为方式也新颖,每次吸血都会产生防御素,并将这种特性一代代传承下去。“我们有一个好想法,但它是建立在许多实验室工作的基础上,”莱克尔说。“重要的是,经过 15 年的努力,制造转基因蚊子已经变得司空见惯。现在我们可以解决更多问题了。”
科学家们在制造有用的蚊子方面面临的主要挑战是,设计出一种无法传播疟疾的蚊子。为此,他们不得不将注意力从实验室宠儿埃及伊蚊转移到冈比亚按蚊(Anopheles gambia)上,它是导致疟疾的疟原虫的主要携带者,因此也是地球上最危险的蚊子。尽管冈比亚按蚊更难繁殖和饲养,但它的基因组已经被很好地理解。而莱克尔本人则相信,可以将在埃及伊蚊中刺激防御素产生的基因插入到冈比亚按蚊中。
与此同时,莱克尔的竞争对手们也在研究其他可能性。安东尼·詹姆斯已成功地在埃及伊蚊中插入了一种基因,该基因通常能刺激小鼠产生疟疾抗体,他最终希望尝试将这种技术应用到冈比亚按蚊上。凯斯西储大学医学院(Case Western Reserve School of Medicine)的马塞洛·雅各布斯-洛雷纳(Marcelo Jacobs-Lorena)正在研究如何诱导实验室蚊子产生可以覆盖其唾液腺并阻止寄生虫进入的肽。弗兰克·柯林斯等人则专注于创造一种突变的冈比亚按蚊,通过用坚硬的色素外壳“黑色素化”来杀死寄生虫。开发出一种能够杀死疟疾并主导蚊子基因池的转基因冈比亚按蚊似乎只是时间问题。
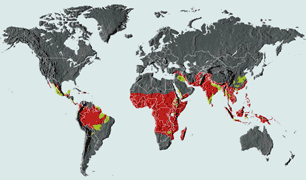
在蚊子传播的许多疾病中——登革热、黄热病、西尼罗河热、裂谷热——疟疾是最致命的。它每年感染至少 3 亿人,每天夺走 3000 人的生命。

随着莱克尔等人逐渐接近目标,他们也面临着一场日益激烈的争论:制造这种基因工程生物并将其释放到环境中是否可行或明智。首先,需要为估计的 100 种传播影响人类疾病的蚊子种类分别制造转基因蚊子。更复杂的是,这些蚊子的品系因地而异。此外,还有多媒介的问题。在世界某些地区,一些疾病有主要、次要甚至第三级传播媒介。“在马里的姆普提村,有七种不同的蚊子传播疟疾,”安德鲁·斯皮尔曼说。这七种蚊子每一种在基因上都不同,为了对抗疟疾,基因工程师可能需要制造七种不同的转基因蚊子。斯皮尔曼补充说,即使蚊子制造者成功了,其他动物的经验也表明转座子可能会失去效力。
如果这些问题还不够,而蚊子工程师们设法生产出了适合各种场合的完美昆虫,那么哪个村庄或城镇会愿意释放一百万只左右的叮咬性害虫呢?斯皮尔曼在实地工作的五十年的经验使他得出结论:在人们居住的任何地方释放蚊子“几乎肯定是不切实际的”。他回忆说,20 世纪 70 年代在印度,世界卫生组织曾派遣小组到小村庄释放成千上万只经过辐射灭活的雄性蚊子。
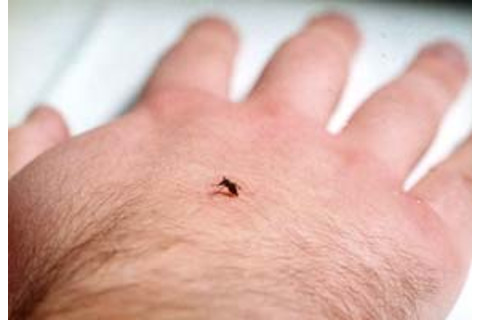
莱克尔的团队对经过改造的埃及伊蚊进行保护性观察,有时甚至让这些微小的昆虫叮咬他们,吸食他们的血液。
理论上,这些绝育的雄性蚊子会与雌性交配,而蚊子通常一生只交配一次,因此不会有后代。然而,项目刚开始不久,就有传言称这是某个外国政府企图通过蚊子叮咬使人类绝育。科学家们被愤怒的居民赶走,项目也被取消了。在当今这个转基因蔬菜都会引发抗议的时代,任何试图将卡车装载的转基因昆虫送入人们后院的努力,“都不会成功,”斯皮尔曼说。
备受尊敬的斯皮尔曼的警告被认真对待。但从事转基因研究的细胞生物学家们却不确定他们是否遇到了代沟。“老一辈的人经历了很多失败的想法,所以很怀疑,”詹姆斯说。“我理解。但这并不意味着我们不尝试新事物。”在柯林斯的观点看来,某些地区的疟疾疫情非常严重,激进的解决方案会在许多地方受到欢迎。“任何想法,无论是转基因蚊子还是其他什么,都需要非常公开和全面地解释。但如果你去到一个四分之一的孩子死于疟疾、许多成年人长期生病的村庄,我认为不会有多少反对意见。”
莱克尔也表示同意。他坚信,研发一种安全的、人为制造的蚊子,是战胜世界上最古老、最致命的害虫之一的最佳策略。“我们的敌人一直在寻找新的方法来保护自己,”他说。“我们也必须如此。”