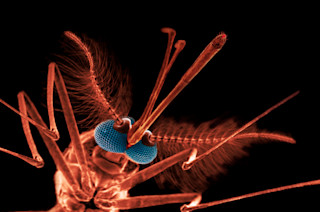
蚊子困扰人类已久,只要我们能挥手驱赶它们。在温带地区,蚊子仅仅是令人烦恼,而在热带地区,它们却携带疟疾和登革热等严重疾病。前者每年导致超过五十万人死亡,其中大部分是 5 岁以下的儿童,而导致疟疾的寄生虫对药物的抗药性也在不断增强。与此同时,世界卫生组织认为登革热是世界上最重要的病毒传播疾病,自第二次世界大战以来,病例增加了三十倍——每年感染多达 5000 万例。
如果您能阻止蚊子这种疾病的传播媒介,您就能阻止它们的微生物载荷,但这说起来容易做起来难。自 DDT 从市场上撤下后,非洲、亚洲和拉丁美洲的蚊子已经对当今毒性较低的化学喷雾产生了抗药性。生物防治方法,即利用其他生物(从真菌到鱼类)来对抗蚊子,只取得了部分成功。
随着选择项的减少,研究人员已将基因工程作为蚊子控制的最后手段和新前沿。这里的宏伟目标是改变蚊子的 DNA:不仅要改变实验室捕捉到的蚊子的染色体,还要改变整个物种的染色体。
有两种基本方法。其中更激进的方法,被略带委婉地称为“种群抑制”,将在昆虫的 DNA 中植入一种生化自毁机制,这就像一颗定时炸弹,将整个物种一网打尽。在称为“种群替代”的较温和方案中,基因改造的蚊子将逐渐取代野生蚊子。例如,在实验中,科学家已经移植了基因,使按蚊对引起疟疾的恶性疟原虫具有抵抗力。
对于研究这一问题的数十家实验室来说,找到有用的基因(称为转基因)并非难事——难的是如何将足够多的转基因副本转移到自由活动的种群中。但是,如果蚊子有致命弱点,那就是雄性蚊子的交配本能,它们像制导导弹一样飞向周围的任何雌性。
因此,研究策略是派遣携带 DNA 弹头的雄性蚊子与雌性交配。放飞数百万只,这些经过改造的雄性蚊子在数量和繁殖能力上都超过了它们的野生同类,而下一代蚊子中的很大一部分会继承转基因。理想情况下,这个过程会自我维持,一代又一代地传递基因,直到所有蚊子都被感染。伦敦帝国理工学院的生物学家 Nikolai Windbichler 说:“一旦引入了经过改造的蚊子,实际上就是蚊子在为我们工作。”
种群数量下降
理论上就是这样。到目前为止,只有一家生物技术公司,即英国的 Oxitec 公司,在野外进行了转基因蚊子试验。Oxitec 的目标是埃及伊蚊,它最初是北非森林中一种不起眼的蚊子,现在却成为登革热的全球传播者。
通过操纵从卵中孵化出的雄性蚊子,Oxitec 向这些昆虫体内注射了一种基因,该基因会在它们的体内产生一种致命蛋白质。转基因雄性蚊子不会死亡,因为该基因被四环素(一种常见抗生素)灭活,而四环素是它们在实验室饮食的一部分。一旦释放,这些经过改造的雄性蚊子就会聚集当地的大部分雌性蚊子。这些交配产生的后代会在其细胞中表达致命蛋白质,并在成熟前死亡,因为它们的环境中没有四环素解毒剂。
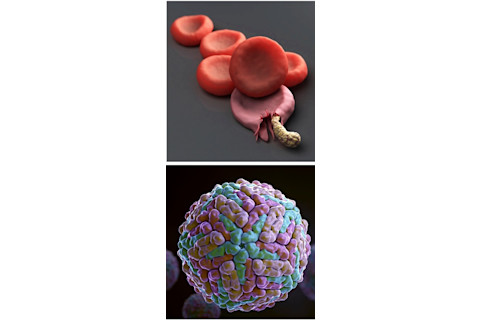
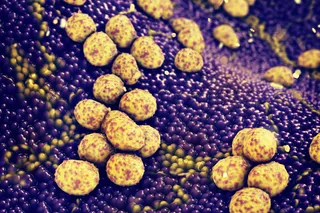
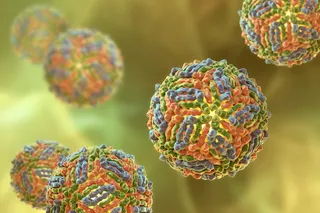
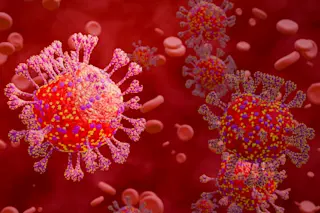
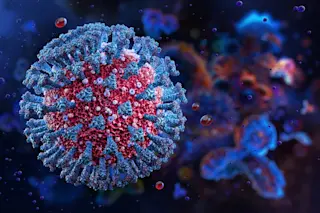
上图:受疟疾寄生虫感染的血细胞。下图:登革热病毒由埃及伊蚊传播。(两者来源:Science Picture Co./Science Source)
该公司表示,在开曼群岛(2009-10 年)、巴拿马(2014 年)和巴西(进行中)进行的该方法的现场试验显示了良好的结果。在几个月的时间里,该过程将当地蚊子种群的数量减少了 80% 或更多。如果美国环保机构批准,Oxitec 的下一次投放可能很快就会在美国佛罗里达礁岛群进行。该地区最近零星出现了登革热病例。
这种方法的缺点是必须反复释放蚊子,因为致命的遗传效应只能持续一代。另一方面,如果出现问题,这也可以起到制动作用。
Windbichler 在帝国理工学院的团队开发了一种名为 X-shredder 的更持久的系统,该系统指的是蚊子的 X 染色体。实验对象是传播疟疾的按蚊。
同样,雄性蚊子也被改造了,这次是植入了一种编码酶的转基因,该酶可以切割 DNA。在蚊子和人类中,决定性别的染色体是 X 和 Y。当雄性蚊子产生精子时,只会复制这两个染色体中的一个。如果一个精子包含 X 染色体,X-shredder 酶就会将其切割,实际上是终止了该细胞,而包含 Y 染色体的精子则可以进行受精。由于雌性蚊子总是产生带有 X 染色体的卵子,因此存活下来的蚊子都是 XY——只有雄性。
Windbichler 的技术如果扩大规模,可以在给定种群的一半雄性中建立 X-shredder 基因。随着它们与数量不断减少的雌性交配,X-shredder 雄性将把种群数量推低,直到没有雌性配偶为止。Windbichler 表示,在野外测试这些蚊子还需要一段时间。“我们必须确保所有安全和伦理方面的考虑都已得到解决,”他说。
昆虫渗透
科学家们发现,基因改造会对生物体产生影响,仿佛插入的转基因的重量会拖累它。经过改造的蚊子比其自然对应物适应性差。这可以通过数量上的优势暂时克服,但如果其他条件相等,自然选择最终会从种群中清除该基因。然而,生物技术的世界并非所有条件都相等。
一种名为 CRISPR-Cas9 的新工具正在革新该领域,它允许研究人员编辑几乎任何物种的基因组,并在过程中“智取”自然选择。该工具利用了与 X-shredder 相同家族的 DNA 切割酶 Cas9。在特制 RNA 分子的引导下,编码该酶的基因可以插入到染色体上的任何位置,并像火车头牵引货车一样,将附加的转基因带到该位置。
将 CRISPR-Cas9 复合物——由切割基因、RNA 向导和转基因组成——插入蚊子染色体后,会立即在互补染色体上剪出一个位置。(所有染色体都成对出现。)然后该复合物会自我复制。
因此,蚊子获得了双重剂量,确保它会传递转基因,因为两个染色体都已被改变。当它繁殖时,不仅后代可靠地获得转基因的副本,而且继承的副本也会立即复制自身。因此,与 Windbichler 的 shredder 不同,它只能影响蚊子种群中一半的雄性,CRISPR-Cas9 则由于内部复制,能够将其转基因传播到整个群体中。因此,这种潜在的害虫控制新武器被称为“基因驱动”。
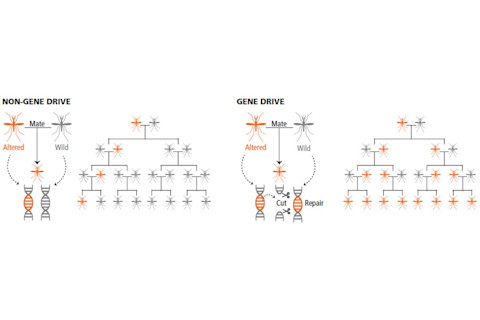
左:继承一个副本的改变基因,每代有 50% 的几率传递下去。右:通过改变两个染色体,基因驱动确保两个副本的改变基因都被继承,从而有 100% 的几率传递下去。(来源:Alison Mackey/Discover,根据 Huey 2014 Science)
Alison Mackey/Discover,根据 Huey 2014 Science
哈佛大学分子进化专家 Kevin Esvelt 曾协助开发了 CRISPR-Cas 基因驱动的原理。2014 年,他和他的同事发表了警告,提醒生物学家要谨慎使用这项技术。“这种事情不应该在不为人知的情况下进行,”他说。“公众有权了解我们正在利用这项技术做什么。” Esvelt 认为,使蚊子对疟疾寄生虫免疫,是 CRISPR-Cas9 的一项积极应用,这比用致命基因驱动来灭绝一个物种要好。
无论计划如何,公众都必须给予同意。“人们确实担心改变野生种群,因为它们是我们共享环境的组成部分,”Esvelt 说。“你需要考虑‘它们是否仍然会为它们应该授粉的花朵授粉?’你需要把所有这些问题都提给生态学家,确保它们不会带来任何负面影响。”
Oxitec 的首席科学家 Simon Warner 将基因驱动比作“瓶子里的精灵”。“一旦它出了瓶子,就回不去了,”他说。但 Esvelt 认为,即使如此,也有解决方案:只需释放第二个基因驱动。“我们可以构建另一个驱动来逆转早期基因驱动的基因组效应。如果基因驱动造成了问题,那么我们可以释放一个逆转驱动,它会针对第一个驱动所做的基因组改变并撤销它们。这是一个非常、非常重要的安全措施。”
很可能,释放一种基因来中和另一种基因不会受到广泛欢迎。相比之下,Warner 说:“Oxitec 的技术是自我限制的。经过改造的蚊子无法生存——它们不会在环境中长期存在。它们会很快消失。”
Oxitec 的技术已获得多个国家监管机构的批准,并在其他方法中处于领先地位。它的战略旨在选择性地抑制城市地区及周边地区的蚊子种群,从而减少人们居住地的疾病传播。如果这些方法不起作用——那么,蚊子们,请当心。致命的基因驱动正在加速引擎。
[本文最初以“基因改造的蚊子”为题发表。]