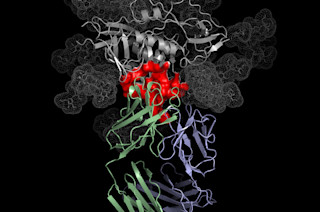
蛋白质结合病毒的结构图。(图片:NIH) 从 DNA 到 RNA 再到蛋白质,生物活性分子的核心生产线是一个经过极其精细调控且具有丰富进化历史的过程。从四种核苷酸组成的字母表中,三个字母一组的密码子指定 20 种氨基酸中的一种,以构建维持新陈代谢所需的酶。然而,在这个过程中也存在一些可以操纵的空间,生物学家们发现了一个重要的“漏洞”,可以利用它来破解系统,为不同的蛋白质引入新的功能或感应能力。构建氨基酸链需要四个关键组成部分。氨基酸(1)通过 tRNA 合成酶(3)连接到其特定的相应 tRNA 载体(2)。tRNA 用一只手握住氨基酸,另一只手在 mRNA(4)上寻找特定的密码子三联体,如果所有部件都契合,则将其携带的货物添加到新生的蛋白质中。
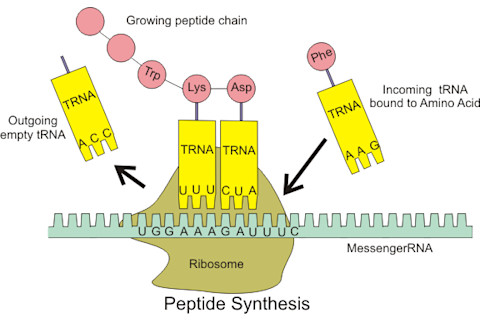
肽合成的基础。肽链最终折叠成具有功能的完整蛋白质。(图片:Wikipedia/ Boumphreyfr) 但是,有 64 种可能的密码子(4 的三次方),而只有 20 种氨基酸,因此存在简并性:例如,RNA 三联体 AGU 和 AGC 都编码丝氨酸氨基酸。还有三个密码子被指定为“停止”指令——UAG、UAA 和 UGA——它们会切断肽链,使新的蛋白质得以生成。对于合成生物学家来说,停止密码子是最容易的目标。如果能够引入一套新的工具——一种将非天然氨基酸连接到导入的 tRNA 上的特殊 tRNA 合成酶——并使其识别其中一个停止密码子,那么细胞就可以将非天然氨基酸掺入其蛋白质中。然而,整个过程必须完全独立于典型的细胞机器。如果一个“正常”的氨基酸连接到新的 tRNA 上,如果非天然氨基酸被加载到标准的 tRNA 上,或者如果添加的 tRNA 实际上识别了非停止密码子——这些都会将非天然氨基酸添加的“手术刀”变成钝化的黄油刀。2006 年,加州拉霍亚斯克里普斯研究所的科学家们找到了一种方法,使所有这些运动部件协同工作。他们使用了一种来自嗜热古菌Methanocaldococcus jannaschii 的 tRNA 和 tRNA 合成酶,将外来氨基酸掺入到大肠杆菌E. coli 培养物的功能性蛋白质中。随着这一进展,大门敞开,在过去的十年里,至少有 71 种非天然氨基酸被插入到天然蛋白质中。其中一些可以作为蛋白质生物化学的纳米级探针:例如,对溴苄基苯丙氨酸在特定波长下吸收光,并且该信号会根据局部氧化还原条件进行调节。在不同细胞条件下跟踪其吸收情况,可以精确指示电子转移反应发生的时间。其他非天然氨基酸是荧光的,提供比 GFP(本身就是一个完整的蛋白质)等典型生物分子小得多的视觉标记。这一特性提供了蛋白质在细胞内实时移动和相互作用的动态视图。也许最令人瞩目的是,非天然氨基酸不仅可以被插入到蛋白质中用于探测其自然活性和动态,还可以用于改变其自身的功能。这个新兴领域中最热门的趋势是掺入金属结合的人工氨基酸,其目标是将酶的鲁棒性和高活性与金属的反应性结合起来。今年早些时候,荷兰格罗宁根大学 Ivana Drienovska 领导的一个团队在《化学科学》杂志上发表了一份报告,将一种金属结合的丙氨酸衍生物插入到大肠杆菌E. coli 蛋白质中。通过将铜的电子转移能力纳入产物中,该团队能够以高能量效率构建几何形状特异性的碳链。最终,这些对生物系统的功能增强可能会开启一个全新的生物化学领域,实现更高效、更稳定的有用产品的生产。通过结合生物体自我维持的韧性与合成化学的精确性,经过改造的活体蛋白质可能就是未来微型工厂。