相变——物质从一种状态转变为另一种状态——在食物和烹饪中无处不在。黄油从固体到液体的相变可以制作出酥脆的派皮,而水从液体到气体的相变可以用来蒸蔬菜。有各种方法可以操纵这些相变,例如通过改变温度、压力或盐含量。在本经典的家庭实验中,我们将使用盐来改变水的相行为,从而制作冰淇淋。
目标
理解溶质(盐)如何影响溶剂(水)的相行为。
利用凝固点降低制作一批美味的冰淇淋。
材料
1 杯 奶油
1/2 杯 糖
200 克 冰
犹太盐
1夸脱(约0.95升)的Ziploc袋
1加仑(约3.78升)的Ziploc袋
温度计
秤
第一部分:使用盐降低冰的熔点
为了在没有冰箱的帮助下成功冷冻冰淇淋,我们需要一种方法来有效地将热量从冰淇淋中移走。液态水比固态冰更能有效地传递热量,因此冰水浴比纯冰更能吸收我们冰淇淋的热量。然而,为了有效地冷冻冰淇淋,我们需要稳定的、远低于0°C的温度。如何在温度低于0°C(水的凝固点)时,拥有水和冰的混合物? 当您直接从冰箱中取出冰时,冰的温度将与冰箱本身大致相同。家用冰箱的温度通常在0°C到-20°C之间。当冰放在外面时,它会吸收周围环境的热量,并缓慢变暖,直到达到0°C并开始融化。添加杂质(如盐)到冰中会降低其熔点。这意味着加盐的冰会在低于0°C的温度下开始融化。因此,加盐的冰水浴可以在远低于0°C的温度下保持液态,并有效地冷冻我们的冰淇淋。我们将这种现象称为“凝固点降低”。我们可以使用凝固点降低方程来计算当添加溶质时,溶剂的凝固点会下降多少。
ΔTf 凝固点降低,定义为纯溶剂的Tf – 溶液的Tf。Kf 溶剂的依数性常数。这是溶剂的固有属性。b 溶质的摩尔浓度:每公斤溶剂的溶质摩尔数。i 每分子溶质的离子粒子数,也称为“范特霍夫因子”。盐由一个钠离子和一个氯离子组成,因此其范特霍夫因子为2。
ΔTf = b · Kf · i
使用凝固点降低方程计算需要多少盐(我们的溶质)才能将水的凝固点(我们的溶剂)从(a)0°C降低到-5°C,(b)0°C降低到-10°C,(c)0°C降低到-15°C,以及(d)0°C降低到-20°C。
绘制凝固点降低的绝对值(ΔTf)与盐浓度(从1a、b、c和d得到的结果)的关系图。请记得使用单位!
根据您在1d中的答案,计算制作200克冰的-20°C凝固点降低需要多少克盐。这就是您将在第二部分使用的盐量。
一些有用的数值:纯水的凝固点(Tf):0°C。水的依数性常数(Kf):1.853 °C*kg/mol。食盐(NaCl)的分子量:58.44 g/mol。
第二部分:利用凝固点降低制作冰淇淋
将奶油和糖混合在夸脱大小的袋子里,充分混合。将这个袋子放入加仑大小的袋子里。
记录冰和奶油混合物的初始温度。
在加仑大小的袋子里,将冰堆在夸脱大小的袋子周围,然后将计算出的盐量撒在冰上。注意不要让盐掉入奶油混合物中。
轻轻摇晃袋子,直到奶油混合物凝固成冰淇淋。
记录冰盐水混合物和冰淇淋的最终温度。
享用您的自制冰淇淋!
问题
冰淇淋的最终温度是多少?它低于0°C吗?与盐冰水混合物的温度相比如何?
盐冰水混合物的最终温度是多少?比您开始时的冰温度更热还是更冷?与您在第一部分计算的凝固点降低相比如何?
讨论
在这个实验中,我们使用盐来降低水的凝固点。通过在冰中加入盐,我们能够获得一种盐冰水混合物,能够冷冻我们的冰淇淋。为什么冰淇淋需要低于水的凝固点的温度才能冷冻?当水结冰时,它会形成一个有序的晶体结构(冰块)。这种独特的晶体结构使固态水具有稍低的密度。尽管冰淇淋是奶油、糖和调味品的组合,但它仍然大约含有60%的水。其余的40%是糖分子、脂肪球和牛奶蛋白的混合物[1]。这种液体混合物是乳化的:水分子分散在糖分子、牛奶蛋白复合物和大的脂肪球簇中。当将这种混合物带到水的凝固温度时,脂肪、蛋白质和糖会阻碍结晶过程,从而干扰有序晶体水结构的形成。因此,冰淇淋混合物仍然是液体,需要低于0°C的更低温度才能成功固化[2]。
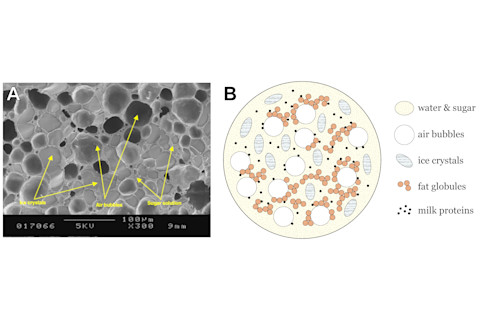
冰淇淋的结构。(A)一张显示气泡、冰晶和糖溶液的冰淇淋的电子显微照片[3]。在此分辨率下,脂肪球和牛奶蛋白不可见。(B)改编自圭尔夫大学的冰淇淋结构图。
我们实验中的盐如何产生低于0°C的盐冰水混合物?在0°C时,冰和水彼此“处于平衡状态”。总的水和冰的量相对恒定,但单个水分子不断地改变状态:当一些水分子融化成液体时,其他水分子结冰成固体。添加盐等溶质会改变这种平衡。溶质本质上将水分子“困”在液态,阻止它们容易地切换回固态。在宏观尺度上,盐会使固体冰更快地融化,并在低于0°C的温度下融化,从而产生低于0°C的盐冰水混合物。为了更深入地了解这个过程在分子层面上是如何工作的,请查看此交互式演示
了解温度和溶质如何影响水冰平衡。与普遍的看法相反,向冰中加盐并不会让冰变得更冷!您记录的盐冰水混合物的温度可能比您开始时的纯冰温度更低。这怎么可能?当您测量固态冰的温度时,您并不是真正测量冰本身的温度——您测量的是冰、冰周围的空气以及任何因冰融化而形成的水的平均温度。冰的真实温度取决于它来自的冰箱的温度(通常在0°C到-20°C之间)以及冰离开冰箱的时间长短。
在线资源
来自《食物与烹饪》的更多内容
McGee, Harold. On Food and Cooking. Scribner, 2004. (39–44)。
引用的参考文献
Goff HD (1997) 冰淇淋的胶体方面——一篇综述。International Dairy Journal 7: 363–373。doi:10.1016/S0958-6946(97)00040-X。
Hartel RW (1996) 冰淇淋生产过程中的冰结晶。Trends in Food Science & Technology 7: 315–321。doi:10.1016/0924-2244(96)10033-9。
Clarke C (2003) 冰淇淋的物理学。Physics Education 38: 248–253。doi:10.1088/0031-9120/38/3/308。

关于作者
Liz Roth-Johnson 是加州大学洛杉矶分校分子生物学博士候选人。如果她不在实验室,你通常会在厨房里找到她进行实验。阅读更多 Liz Roth-Johnson 的文章















